加利福尼亚大学欧文分校领导的一项研究表明,葡萄糖基转移酶结构域 (GTD) 是艰难梭菌感染 (CDI) 治疗干预的理想分子靶标。这些发现可能会导致新的治疗方法来对抗这种致命的疾病。
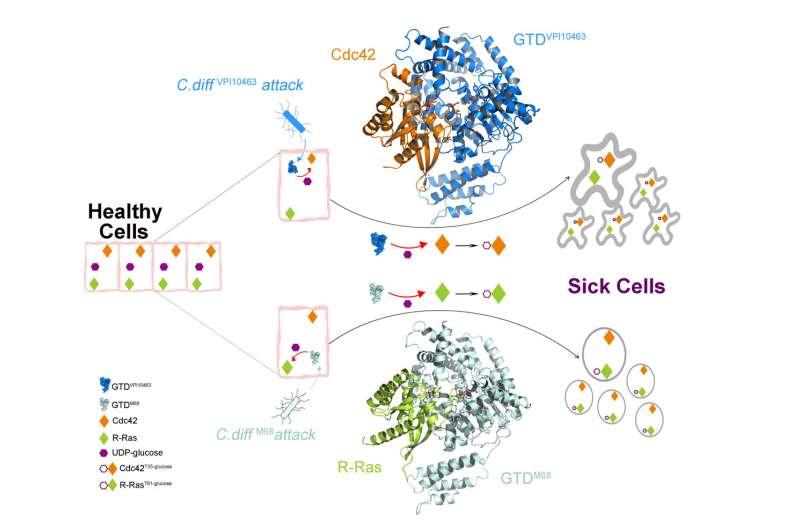
基于他们的发现为小 GTPases Rho 和 R-Ras 家族的毒素 B 识别奠定了结构基础,这项题为“艰难梭菌毒素 B 选择性修饰 Rho 和 Ras GTPases 的结构基础”的研究今天发表在科学进展。
CDI 是全球抗生素相关腹泻和胃肠炎相关死亡的主要原因,美国每年有 500,000 例病例和 29,000 例死亡,被疾病控制和预防中心列为最大的健康威胁之一。全球越来越关注高毒力艰难梭菌菌株的出现和传播,类似于当前 COVID 大流行中新病毒变体的出现。TcdB 是两种同源的艰难梭菌外毒素之一,单独的 TcdB 能够引起全谱 CDI 疾病。
“我们专注于 TcdB 关键 GTD 的结构和功能,它是毒素的‘弹头’。GTD 由宿主细胞内的毒素传递,并对患者造成大部分细胞质损伤,”UCI 医学院生理学与生物物理学系教授、通讯作者 Rongsheng Jin 博士说。“我们发现的分子机制,通过该GTD特异性识别并阻断人GTP酶的Rho和R-RAS酶是关键信号分子家族的生理功能。”
该团队还展示了经典形式的 TcdB 和超毒力 TcdB 如何以不同的方式识别它们的人类目标,从而导致细菌入侵导致宿主细胞发生明显的结构变化。
“一旦 TcdB 的 GTD 进入细胞内,它就会被我们的细胞屏蔽,并且无法进行被动免疫疗法。但我们的研究表明,可以开发小分子抑制剂来解除 GTD 的武装,这将直接消除疾病症状的根本原因和细胞损伤,”金说。“这种新策略有可能与其他 CDI 治疗方案整合并补充。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!