一种称为间淋巴瘤激酶 (ALK) 的分子是多种癌症的驱动因素,包括小儿神经母细胞瘤、B 细胞淋巴瘤和肌成纤维细胞肿瘤。但多年来,关于这种分子的很多方面——它在体内的作用、哪些分子与其相互作用、它的外观——仍然未知,限制了针对它进行治疗的努力。
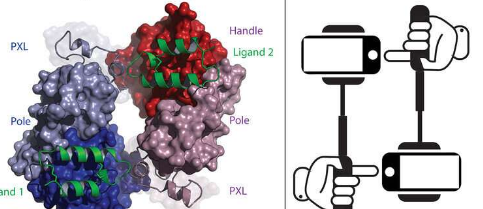
现在,耶鲁大学领导的两项研究于 11 月 24 日发表在《自然》杂志上,揭示了这种分子的结构,为癌症治疗发展开辟了新途径。
ALK 分子是一种受体——一种位于细胞膜中并对与其结合的其他分子作出反应的蛋白质——主要存在于大脑和中枢神经系统中。几十年来,它一直被描述为“孤儿受体”,因为它的配体——或与之结合并激活它的物质——直到 2015 年耶鲁大学的研究人员解开这个谜团才为人所知。这一发现是了解这种受体及其作用的重要一步在人体中播放。
研究人员说,揭开它的结构代表着又一次飞跃。
“要针对这样的受体进行治疗,您想知道如何阻断或刺激它,但除非您知道其结构,否则您无法做到这一点,”药理学教授兼药理学教授约瑟夫施莱辛格说。耶鲁大学药理学系。
受体是我们的身体向特定细胞或组织发送信号或信息的方式之一。它们对特定物质做出反应,一旦这些物质附着在受体上,就会引起某种作用——受体可以被激活或失活,而这种作用将对受体所在的细胞产生影响。
药理学助理教授达里尔·克莱因 (Daryl Klein) 是两项新研究中第一项的资深作者。在这项研究中,他和他在耶鲁大学癌症生物学研究所的同事使用 X 射线晶体学来可视化 ALK 与其他分子结合的部分,让他们看到它的结构。
事实证明,这种结构非常不寻常——一个关键部分以前从未在人类蛋白质中发现过。“这真的,真的,令人惊讶,”克莱因说。
意想不到的区域由甘氨酸链组成,甘氨酸是一种氨基酸,或者是蛋白质的组成部分。该区域是受体的一个极其坚硬和稳定的部分,在 ALK 在细胞膜内的整体定位中起着关键作用。Klein 说受体这部分的突变与癌症有关,了解这些突变对受体结构及其功能的影响对于了解它们如何导致癌症至关重要。
由博士后研究员李同庆和高级研究科学家史蒂文斯泰鲁克领导的克莱因研究团队能够观察到 ALK 在与其配体结合后如何激活。具体来说,他们发现两个配体结合的 ALK受体结合在一起,每个都抓住了另一个。两个分子的这种连接称为二聚体,一旦两个 ALK 分子形成二聚体,受体就会被激活。
克莱因说,这一发现让研究人员提出了下一个问题:“我们如何才能在受体开启但不应该关闭的情况下使其失活,就像癌症发展时一样?”
使用已知与 ALK 相互作用的两种抗体,Klein 和他的团队能够做到这一点,观察由总部位于纽黑文的 Celldex Therapeutics 公司提供的抗体如何破坏 ALK 的功能。一种阻止配体与 ALK 结合,而另一种阻止两种 ALK 受体结合并激活。
Klein 说,这些信息将为开发癌症治疗提供强有力的见解。事实上,他的团队正在努力利用这种结构来创造新的疗法。“我们现在确切地知道我们想要防止激活的目标,”他说。
由施莱辛格的实验室和圣裘德儿童研究医院的研究人员共同领导的一项单独研究使用了额外的方法来评估 ALK 的结构。通过 X 射线晶体学、低温电子显微镜和核磁共振波谱,研究人员揭示了 ALK 的原子细节以及它如何被其天然配体激活。
通过这些技术,该团队得出了与 Klein 相同的结论——ALK 具有不寻常的结构,具有在同一家族的其他受体中没有的独特特征。甚至它在细胞膜内的定位也从其他受体中脱颖而出。
“受体位于细胞表面。它不像大多数受体那样垂直于细胞站立,”施莱辛格说。
他说,这种定位导致配体同时与受体和细胞表面相互作用。“这在任何配体-受体相互作用中以前从未见过,”他说。
有了对 ALK 结构的了解,Schlessinger 现在正在研究另一块拼图——它的配体。“我们对它的工作原理一无所知,”他说。“但就像它的受体一样,它也可能在癌症中发挥作用。它也可能在代谢疾病以及这些过程是如何连接的方面发挥作用。”
除了开发治疗方法外,Klein 的团队还致力于了解 ALK 突变如何导致癌症。他们正在解决一个让他首先研究 ALK 的问题——为什么它的配体在脊椎动物和无脊椎动物中不一样。
“为什么在无脊椎动物和脊椎动物中会有不同的配体,而受体本身基本相同?在脊椎动物中从头开始一定有巨大的进化压力——我认为这就是很多故事的所在,”克莱恩说。“答案将揭示一些非常有趣的事情。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!