以抗体为目标的“包膜运载工具”选择性地编辑 T 细胞以创建 CAR T 细胞。
当今大多数批准的基因疗法,包括那些涉及 CRISPR-Cas9 的基因疗法,都对从体内取出的细胞发挥作用,然后将编辑后的细胞送回患者体内。
这项技术非常适合靶向血细胞,目前是新批准的 CRISPR 基因疗法用于治疗镰状细胞性贫血等血液疾病的方法,其中编辑的血细胞在骨髓被化疗破坏后被重新注入患者体内。
CRISPR-Cas9 传递的进展
1 月 11 日发表在《自然生物技术》杂志上的一种新的、精确靶向的 CRISPR-Cas9 递送方法,可以在体内对非常特定的细胞子集进行基因编辑——这是向可编程递送方法迈出的一步,该方法将消除这种需要在给予患者编辑过的血细胞之前消灭患者的骨髓和免疫系统。
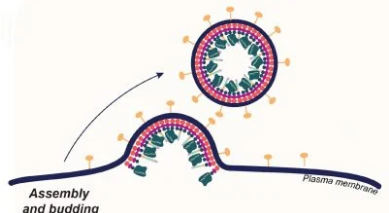
这种递送方法是由CRISPR-Cas9 基因组编辑联合发明人 Jennifer Doudna 的加州大学伯克利分校实验室开发的,涉及将 Cas9 编辑蛋白和引导 RNA 包裹在装饰有单克隆抗体片段的膜泡中专注于特定类型的血细胞。
探索病毒包膜
作为演示,创新基因组研究所 (IGI) 杜德纳实验室的 CRISPR 研究员 Jennifer Hamilton 将免疫系统的一个细胞(T 细胞)作为目标,这是一种称为嵌合抗原受体的革命性癌症治疗的起点(CAR) T 细胞疗法。 Hamilton 和她的同事对配备了人源化免疫系统的活小鼠进行了治疗,并将它们的人类 T 细胞转化为 CAR T 细胞,能够瞄准并消除另一类免疫细胞(B 细胞)。
汉密尔顿说,这一壮举是一个原理证明,显示了使用这种载体方法(包膜运输工具)来靶向和编辑活体动物(体内)以及最终人类的血细胞和潜在其他类型细胞的潜力。
汉密尔顿说:“我们的方法涉及多重靶向分子,也就是说,我们的粒子上有两个或多个靶向分子,它们与目标细胞相互作用,有点像计算机中的与门。”他指的是仅在两个事件发生时才运行的逻辑电路同时地。 “当颗粒利用两种抗体配体相互作用结合时,我们能够获得更有效的递送。在用 T 细胞靶向载体治疗小鼠后,我们在我们感兴趣的细胞类型 T 细胞中观察到基因组工程,而不是在肝细胞中。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!