胰腺癌仍然是全世界最致命的恶性肿瘤之一。由于胰腺导管腺癌 (PDAC) 患者的五年生存率仅为 3% 左右,因此在全球范围内,PDAC 很难通过手术治疗。要开发新的治疗方法,需要更好地了解 PDAC 在分子水平上的生物学特性。
在最近发表在《癌症科学》杂志上的一篇文章中,东京医科齿科大学 (TMDU) 的研究人员发现了一种新的靶基因,该基因在 PDAC 病例中具有很强的临床意义。
先前的研究表明,癌细胞会高水平表达一种由 SETD1A 基因编码的特殊酶——组蛋白 H3K4 甲基转移酶。这种酶通过称为甲基化的过程向特定靶基因的组蛋白(染色质的基本结构成分)添加甲基化学基团来调节基因表达。然而,导致这种酶过度表达的机制及其对癌细胞的影响仍不清楚。
组蛋白甲基化后,目标基因变得活跃。如果 SETD1A 靶基因可以支持癌症的发展和进展,这一点尤其重要。因此,TMDU 的研究人员对了解 SETD1A 过表达在 PDAC 中的作用产生了兴趣。
“虽然之前的工作表明 SETD1A 在胃癌和肺癌等多种癌症中过度表达,但 PDAC 中 SETD1A 的特定分子事件尚不清楚,”主要作者 Takeshi Ishii 说。“PDAC 中的 SETD1A靶基因也尚未确定。”
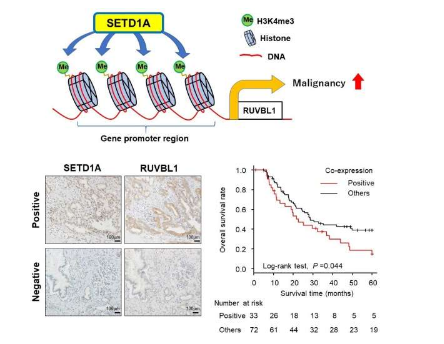
研究人员在他们分析的 51.4% 的人类 PDAC 样本中观察到高水平的 SETD1A 表达。他们还确定 SETD1A 是无病生存的独立预后因素,这意味着在肿瘤切除后,SETD1A 水平高的患者处于无病状态的时间比 SETD1A 水平低的患者短。这些结果证明了 PDAC 中 SETD1A 表达的临床重要性。
然后,他们使用人工培养的 PDAC 细胞来检查改变 SETD1A 表达将如何影响细胞行为。当它们过表达 SETD1A 水平时,细胞生长和细胞迁移能力都会增加。在另一组 PDAC 细胞中,研究人员使用分子技术干扰 SETD1A 表达,然后分析受此影响的其他基因。“使用一种称为 RNA 测序的技术,我们在敲除 SETD1A 后检查了整体基因表达,发现另一种称为 RUVBL1 的基因表达水平较低,”资深作者 Shinji Tanaka 解释说。
进一步的研究表明,SETD1A 可以甲基化 RUVBL1 基因附近的组蛋白并激活其基因表达。敲低 PDAC 细胞中的 RUVBL1 表达具有与早期使用 SETD1A 干扰观察到的生物学效应相似的生物学效应。“生存率分析显示,SETD1A 和 RUVBL1 水平高的 PDAC 患者总体生存率较差,这表明它们的共表达是这种癌症的重要预后生物标志物,”Takeshi Ishii 说。
标签:
免责声明:本文由用户上传,如有侵权请联系删除!