研究人员发现了蛋白质α-突触核蛋白的结构与其错误折叠和聚集的可能性之间的联系。
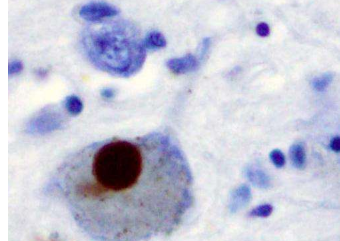
α-突触核蛋白聚集体是神经退行性疾病(例如帕金森病)的标志。他们的发现今天发表在Nature Communications上,确定了治疗帕金森病的潜在新治疗靶点。
人脑含有一种称为α-突触核蛋白 (aSyn) 的蛋白质,它主要存在于称为突触前末梢的结构中的神经元尖端。在帕金森病和其他一些神经退行性疾病中,aSyn 蛋白变得不稳定、错误折叠并聚集成不溶性原纤维,这是该疾病的标志。目前我们不明白为什么 aSyn 会错误折叠或如何阻止它这样做。这意味着像帕金森病这样影响英国每 350 名成年人中就有一人的疾病仍然无法治愈。
“我们想了解为什么正常情况下健康的单体可溶性 aSyn 突然开始错误折叠,”该研究论文的第一合著者、剑桥大学化学工程与生物技术系的 Amberley Stephens 博士说。
“了解错误折叠途径中的这些初始步骤意味着我们可以确定治疗 aSyn 错误折叠障碍的新治疗靶点。然而,这变得非常困难,因为 aSyn 没有真正的结构,而是以许多高度动态的中间结构或构象存在。”
为了了解如何阻止 aSyn 在神经元中聚集,研究人员必须研究单体 aSyn 在易于聚集时与不易聚集并因此保持单体时形成的初始构象。研究人员通过添加已知的聚集诱导离子钙,有目的地使 aSyn 聚集更快,以研究单体动态结构中的这些微小差异。
该团队使用一系列尖端分析技术来研究当 aSyn 处于易聚集或非易聚集状态时发生的各种分子内相互作用。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!