香港大学李嘉诚医学院(港大医学院)生物医学学院马桂仪教授领导的研究团队发现了一条新的信号通路,通过RNA编辑控制脂质代谢,从而促进胃癌对化疗的抵抗力和癌症干细胞性。研究结果发表在《自然通讯》杂志上。
胃癌(GC)仍然是全球和香港癌症相关死亡的主要原因之一。为了对抗GC,除了手术切除之外,通常还进行5-氟尿嘧啶(5-FU)和铂类联合化疗,以期提高手术效果或尽量减少癌症复发的机会。然而,获得性化疗耐药性的出现最终会削弱长期的临床益处。
驱动化学抗性的多种机制,与构成各种亚型的GC相结合,模糊了克服化学抗性的靶标的识别。因此,了解亚型特异性的克服化疗耐药性的脆弱性对于为这种致命疾病设计改进的治疗方案至关重要。
研究方法及结果
研究小组发现了一种未报道的驱动化疗耐药性的机制,通过该机制,RNA水平的失调编辑会引发脂质代谢异常,从而赋予化疗耐药性和癌症干细胞性。
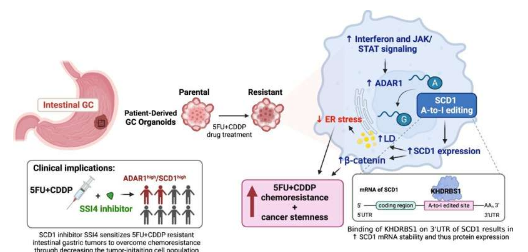
通过整合临床肠胃癌患者来源的类器官系,经过训练以模拟 5-FU+ 顺铂耐药性,在临床前 GC 小鼠模型中进行多组学分析和验证,研究小组发现,化疗耐药类器官表现出更强的干扰素和 JAK/STAT 信号传导,从而上调 ADAR1 表达。ADAR1 是一种控制 RNA 编辑的酶,它通过编辑参与脂质代谢的多种酶(包括关键酶 SCD1)来促进脂质网络失调。
SCD1 RNA 的编辑增强了 mRNA 的稳定性,从而增加了 SCD1 蛋白的表达。因此,SCD1 促进脂滴形成和 β-连环蛋白丰度,从而赋予化疗耐药性以及更多的癌症干性状态。为了将研究结果应用于临床,研究小组进一步证明,在化疗方案中补充 SCD1 抑制剂 (SSI4) 可以逆转胃癌的化疗耐药性并减少肿瘤起始亚群。
标签:
免责声明:本文由用户上传,如有侵权请联系删除!