NIST 的一组研究人员揭示了多种炎症小体激活背后的分子机制及其在诱导炎症细胞死亡中的作用。这一发现揭示了先天免疫传感器之间的联系,并为先天免疫和炎症小体生物学中炎症小体的功能提供了有价值的见解。
这些发现还有可能为 NLRP3、AIM2、NLRC4 和 Pyrin 介导的疾病确定新的治疗靶点。该研究已发表在《细胞与分子免疫学》杂志上。
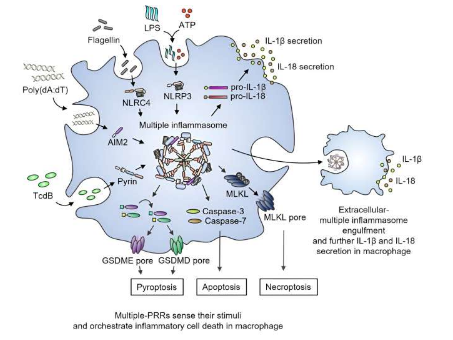
炎症小体是先天免疫防御的重要哨兵,感知病原体并触发受感染细胞的细胞死亡,从而在炎症、发育和癌症中发挥重要作用。这些炎性体传感器检测特定的病原体和损伤相关分子模式(PAMP 和 DAMP),并与接头 ASC 和 caspase-1 形成复合物。然而,整合多个炎性体传感器以实现最佳宿主防御仍然难以实现。
由UNIST生物科学系SangJoon Lee教授领导的研究小组研究了各种配体同时激活多个炎症小体的情况。他们发现这种激活引发了不同类型的程序性炎症细胞死亡,这种死亡不能通过使用任何单个炎症小体的单一纯配体进行治疗来复制。
研究小组将 NLRP3、AIM2、NLRC4 和 Pyrin 与 ASC、caspase-1、caspase-8 和 RIPK3 一起识别为大型多蛋白复合物的成员。人们发现这种复合物可以驱动一种称为全凋亡的过程,涉及多种类型的炎症细胞死亡。
此外,多蛋白复合物被释放到细胞外空间,形成多个细胞外炎性小体颗粒。这些颗粒被邻近的巨噬细胞吞噬时会引发炎症。这一发现强调了炎症小体传感器之间以前未知的调节联系和分子相互作用,导致包括多个炎症小体传感器和细胞死亡调节因子的多蛋白复合物的组装。
这些发现的意义超出了基础研究的范围。了解 NLRP3、AIM2、NLRC4 和 Pyrin 之间的关键相互作用,为理解这些分子在先天免疫和炎症小体生物学中的功能开辟了新途径。此外,它为确定这些炎症小体介导的疾病的潜在治疗靶点铺平了道路。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!