研究人员确定了对肠道炎症的发展和预防至关重要的途径
已知有 200 多个不同的基因组区域可以调节 IBD 的风险。然而,这些风险基因促进 IBD 的具体途径和与环境的相互作用在很大程度上仍是未知的。“遗传和环境的相互作用使 IBD 成为一种非常复杂的疾病。此外,这是一项特别具有挑战性的研究,”德累斯顿工业大学德累斯顿再生治疗中心 (CRTD) 研究组组长、德累斯顿大学医院分子胃肠病学副教授 Sebastian Zeissig 教授说。
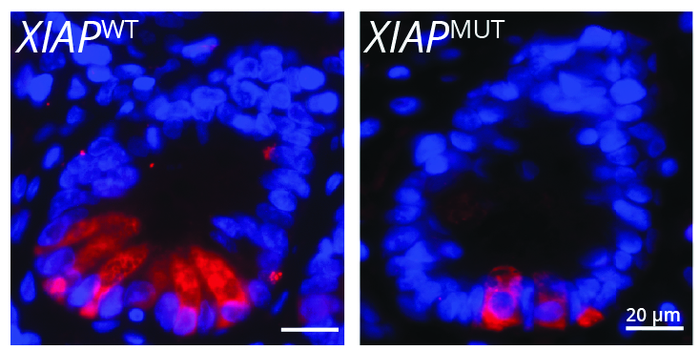
Zeissig 教授领导的一个小组研究了X 连锁凋亡蛋白抑制剂(XIAP)基因的突变。大约 30% 的患有这种遗传病的人会患上 IBD,这表明该疾病有很大的遗传因素,但也表明遗传背景只是等式的一部分。Zeissig 教授和他的团队研究了XIAP突变,以检查这种遗传缺陷和环境因素之间的串扰如何促进 IBD。
破坏针对细菌的免疫反应的遗传缺陷
研究人员观察到,人类和小鼠中XIAP基因的缺失与潘氏细胞(小肠内壁的细胞)的缺陷有关。“潘氏细胞对于控制微生物组至关重要,”蔡西格教授解释说。“这些细胞产生充当抗生素的小分子。当分泌到肠道时,这些分子会杀死细菌。通过这种方式,微生物组的组成得到了控制,并且可以防止细菌进入肠道组织。”如果没有功能性XIAP基因,Paneth 细胞就无法在相同程度上产生和释放抗菌分子。这反过来又导致微生物组失衡。
基因加载枪,但环境扣动扳机
“令人着迷的观察是,尽管存在这些缺陷,小鼠并没有发生肠道炎症,”蔡西格教授说。只有在引入一种对普通小鼠无害的特定类型的细菌后,XIAP基因缺陷的小鼠才会出现让人联想到 IBD 的肠道炎症。“这可以解释为什么大多数具有该基因突变的患者不会发展为 IBD。遗传条件产生易感环境。但最终引发炎症的是接触特定细菌,”蔡西格教授解释说。
新疗法的潜力
在观察到XIAP基因的缺失导致 Paneth 细胞受损和微生物组失衡后,研究人员决定测试一种可能的干预措施。他们将类似于健康潘氏细胞产生的抗菌分子重新引入具有遗传缺陷的小鼠。即使在致病细菌存在的情况下,这些分子也能够预防肠道炎症。
这些结果表明个性化 IBD 治疗的潜在新机会。“抗菌分子是否可能成为一种潜在的治疗选择还有待观察——不仅适用于具有 XIAP 缺失的个体,还适用于其他 IBD 相关遗传缺陷破坏 Paneth 细胞的个体,”Zeissig 教授补充道。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【广西南宁三甲医院列表有哪些】在广西南宁市,三甲医院作为医疗资源的重要组成部分,承担着区域内的疑难重症...浏览全文>>
-
【广西南宁建设学校】“广西南宁建设学校”是一所位于广西壮族自治区南宁市的教育机构,专注于建筑类及相关工...浏览全文>>
-
【广西哪里有机场】广西作为中国重要的旅游和交通枢纽省份,拥有多个机场,方便旅客出行。无论是前往南宁、桂...浏览全文>>
-
【广西名酒排名】广西作为中国西南地区的重要省份,不仅自然风光秀美,其酿酒文化也源远流长。虽然广西不像四...浏览全文>>
-
【广西民族大学专业】广西民族大学是一所具有鲜明民族特色和多学科协调发展的综合性大学,坐落于广西南宁市。...浏览全文>>
-
【广西米浆的制作方法】广西米浆是一种传统的米制品,常见于广西各地的早餐或小吃中,口感细腻、香滑可口,是...浏览全文>>
-
【广西美女最多的城市推荐】在广西这片美丽的土地上,不仅有壮丽的自然风光和丰富的民族文化,还孕育了许多气...浏览全文>>
-
【广西麻将怎么打】广西麻将是一种流行于广西地区的传统麻将玩法,其规则与常见的四川麻将、广东麻将等有所不...浏览全文>>
-
【广发银行和工商银行一样吗】广发银行和中国工商银行(简称“工行”)都是我国重要的商业银行,但它们在性质...浏览全文>>
-
【广发银行贷款条件】广发银行作为国内知名的商业银行之一,提供多种贷款产品,以满足不同客户的资金需求。无...浏览全文>>
