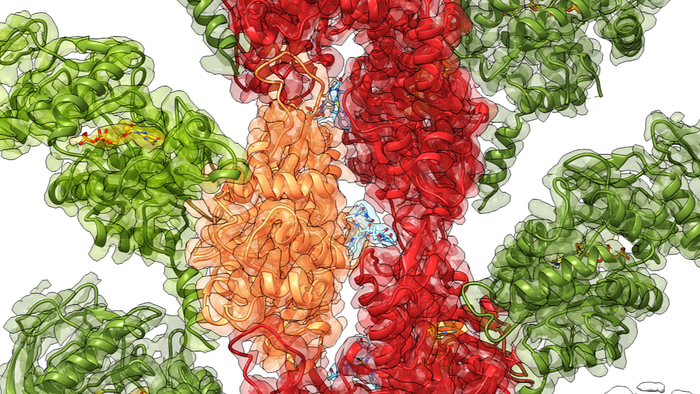
来自德国多特蒙德马克斯普朗克分子生理学研究所的研究人员与法国巴黎巴斯德研究所合作,首次发现了当与肌动蛋白相互作用时,毒素的结构如何变得更加有序,肌动蛋白是主要的肌动蛋白之一。细胞骨架的组成部分。似乎 ExoY 与肌动蛋白的对接诱导了毒素酶核心的稳定下坡,这变得容易发挥其有毒功能。科学家们使用冷冻电子显微镜 (cryo-EM) 和计算模拟来获得结合前后毒素的结构细节,以及酶分析来量化毒素的活性。他们的研究结果已发表在《自然通讯》杂志的网络版上。
多特蒙德马克斯普朗克分子生理学研究所所长、这项研究的主要作者 Stefan Raunser 详细解释了这项研究:
您的发现是什么,为什么令人兴奋?
我们的团队在分子水平上揭示了毒素 ExoY 如何通过与宿主分子的相互作用在细胞内被激活。有趣的是,这不是直接影响。注入细胞后,毒素与肌动蛋白丝对接,稳定之前扭曲和弯曲的毒素外围部分。这种构象变化还导致毒素活性核心的稳定,然后准备好进行破坏性的酶活性。我们将这种从远处开始的重排称为“变构稳定”,这是分子生物学中的一个真正奇迹。
为什么您的研究对科学界很重要?
了解变构稳定背后的机制及其在分子水平上的发生方式至关重要,因为它是酶调节和复杂生物分子系统的中心主题。我们现在可以说这种作案手法是几种毒素的典型。例如,炭疽芽孢杆菌,炭疽病的病原体,使用一种毒素,在与不同的蛋白质结合后,以类似的方式从无序转变为有序。
为什么您的研究对社会很重要?
这些毒素是医院和其他地方发生危险感染的原因。在细胞内部,它们利用其活性核心来损害免疫系统并逃避其反应。活性位点一直是药物开发人员的首要目标,但如果我们找到解毒剂通过攻击变构位点来阻止酶的激活呢?因此,了解蛋白质变构调节的潜在机制可能为新药开发铺平道路,因为它具有多功能性,可提供针对蛋白质靶标的理想选择性,同时最大限度地减少毒性和其他副作用。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!