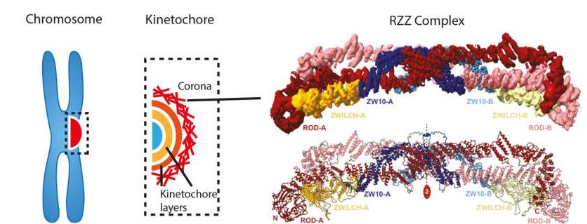
动粒电晕的结构终于揭晓
在母细胞的细胞分裂过程中,必须首先复制携带人类基因组的 23 条染色体,然后再将其传递给两个新形成的子细胞。至少在健康细胞中,结果令人惊讶地完美无缺,并且没有任何染色体丢失。在恶性细胞中并非如此,猖獗的染色体分离错误会产生持续不断的新遗传变异,这些变异支持转移性生长和对化疗的抵抗力。称为动粒的多层蛋白质结构执行染色体递送程序。在高度跨学科的合作巡回演出中,马克斯普朗克分子生理学研究所的 Andrea Musacchio 和 Stefan Raunser 小组研究了这种结构的最外层,即动粒电晕。在单粒子低温电子显微镜和蛋白质重组的帮助下,他们揭示了日冕主要构件 RZZ 复合物的结构组织,并破译了日冕组装的机制。他们的结果阐明了世代相传的基因组遗传的分子基础。
细胞分裂构建了我们的身体,为我们的组织和器官中的所有细胞提供能量,从皮肤到肠道,从血液到大脑。它不仅可以让这些器官生长,还可以在需要时用新鲜细胞再生。细胞分裂始于染色体的复制,染色体是人类基因组 30 亿个核苷酸的载体。然后复制的染色体在称为有丝分裂的过程中分配给子细胞。在有丝分裂期间,称为有丝分裂纺锤体的线状结构网络最初捕获染色体。在高度精心设计的过程中将它们定位后,纺锤体以相反的方向分离染色体,因此当两个细胞从一个细胞中形成时,每个细胞都继承了基因组的精确副本。即使是这个过程中最小的错误也会产生可怕的生理后果。
多层次的挑战
动粒是染色体与纺锤体的接触点,因此在染色体排列和分割过程中起着至关重要的作用。它是一种复杂的多层蛋白质复合物。“理解动粒是一项巨大的挑战,因为它们由几层组成,每一层都由许多相互作用的构建块组成,”Musacchio 说。“最外层,即日冕,保留了动粒的一些最有趣的秘密。它的组装特别有趣,因为复合体的寿命很短,在染色体对齐和分离的关键步骤之前就结束了。”
在之前的一系列研究中,Musacchio 的实验室对动粒不同层的结构和功能以及它们如何将染色体连接到微管进行了基础性研究。为了获得这些知识,该小组采用了一种称为生化重组的还原论方法。他们在试管中产生了细胞外蛋白质网络的各个组成部分。然后,他们将它们一块一块地重新组装,形成一个几乎完整的动粒,他们可以在一个受控和简化的环境中单独研究,与极其复杂、嗡嗡作响的细胞内部形成鲜明对比。
采用相同的策略,由两名博士后 Tobias Raisch 和 Giuseppe Ciossani 组成的技术团队,两名博士。学生、Ennio d'Amico 和 Verena Cmentowski 以及其他同事现在已经能够重建动粒电晕。他们表明,只有两种成分就足够了:ROD-Zwilch-ZW10 (RZZ) 蛋白复合物和 Spindly 蛋白,它在动粒与微管的相互作用中起重要作用。日冕只聚集在动粒上,限制其生长到这些结构的机制仍然是一个关键的未解决问题。通过在体外重建该过程,科学家们能够鉴定出一种酶,即激酶 MPS1,作为在动粒处 RZZ 电晕组装的基本催化剂。
离王冠更近一步
自 1960 年代以来,电子显微镜 (EM) 一直伴随着对动粒的研究,但直到最近,新兴的方法学发展才使这项技术能够在原子尺度上可视化构建块。“2017 年,我们通过 cryo-EM 生成了第一个 RZZ 复合体的 3D 结构模型,”Raunser 说。“然而,在这个初始模型的 1 nm 分辨率下,不可能观察到负责生物功能的最精细的分子细节。”
新的结构分析将分辨率提高到出现原子细节的程度,最终解释了 RZZ 组件与其自身以及与 Spindly 的相互作用如何促进电晕组装成围绕着动粒的大聚合物。Musacchio 总结道:“我们的工作为之前对动粒电晕的一系列研究奠定了基础,现在为我们提供了一个框架来理解细胞分裂的关键时刻,即当染色体与微管的附着变得基本上不可逆时”。该团队未来的研究将尝试将日冕整合到重组的动粒中,朝着体外重建染色体分离迈出新的重要一步,这是一个非凡的目标,将阐明生命最基本的过程。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【广西南宁三甲医院列表有哪些】在广西南宁市,三甲医院作为医疗资源的重要组成部分,承担着区域内的疑难重症...浏览全文>>
-
【广西南宁建设学校】“广西南宁建设学校”是一所位于广西壮族自治区南宁市的教育机构,专注于建筑类及相关工...浏览全文>>
-
【广西哪里有机场】广西作为中国重要的旅游和交通枢纽省份,拥有多个机场,方便旅客出行。无论是前往南宁、桂...浏览全文>>
-
【广西名酒排名】广西作为中国西南地区的重要省份,不仅自然风光秀美,其酿酒文化也源远流长。虽然广西不像四...浏览全文>>
-
【广西民族大学专业】广西民族大学是一所具有鲜明民族特色和多学科协调发展的综合性大学,坐落于广西南宁市。...浏览全文>>
-
【广西米浆的制作方法】广西米浆是一种传统的米制品,常见于广西各地的早餐或小吃中,口感细腻、香滑可口,是...浏览全文>>
-
【广西美女最多的城市推荐】在广西这片美丽的土地上,不仅有壮丽的自然风光和丰富的民族文化,还孕育了许多气...浏览全文>>
-
【广西麻将怎么打】广西麻将是一种流行于广西地区的传统麻将玩法,其规则与常见的四川麻将、广东麻将等有所不...浏览全文>>
-
【广发银行和工商银行一样吗】广发银行和中国工商银行(简称“工行”)都是我国重要的商业银行,但它们在性质...浏览全文>>
-
【广发银行贷款条件】广发银行作为国内知名的商业银行之一,提供多种贷款产品,以满足不同客户的资金需求。无...浏览全文>>
