尽管最近我们对溃疡性结肠炎的致病机制的了解取得了进展,但治疗这种疾病仍然存在相当大的未满足的医疗需求。
由于溃疡性结肠炎是一个多因素和多步骤的过程,因此仅阻断单个炎症细胞因子或免疫学靶标可能不足以治愈这种疾病。可能需要针对溃疡性结肠炎的多种致病基因和途径的联合治疗。
不幸的是,目前的治疗策略通常基于独立的化合物或单克隆抗体,并且联合治疗在治疗溃疡性结肠炎方面尚未实现的全部潜力。
由于小干扰RNA(siRNA)在单剂量下共靶向多个基因的高特异性,效力和灵活性,基于siRNA的疗法为溃疡性结肠炎的联合治疗提供了一种有吸引力的策略。然而,开发合适的siRNA体内递送系统仍然是RNAi治疗的主要瓶颈。
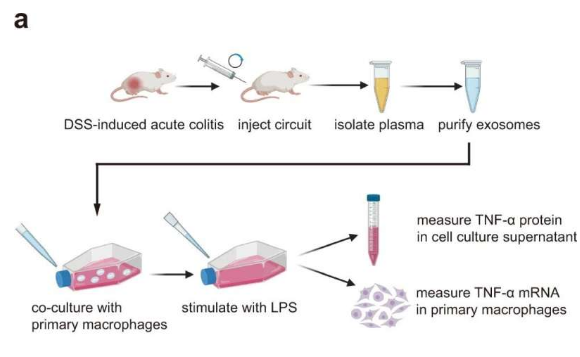
在发表在《自然通讯》上的一项新研究中,由南京大学的张陈宇教授、陈曦教授和张启鹏领导的联合研究小组开发了一种合成生物学策略,将天然存在的小细胞外囊泡系统与人工遗传回路相结合,对雄性小鼠的肝脏进行重新编程,将多个siRNA自我组装成分泌性小细胞外囊泡,并通过循环的小细胞促进体内递送siRNA。 细胞外囊泡用于溃疡性结肠炎小鼠模型的联合治疗。
特别是,重复注射设计用于同时抑制TNF-α,B7-1和整合素α4的多靶点遗传回路,通过抑制结肠巨噬细胞中的促炎级联反应,抑制T细胞的共刺激信号和阻断T细胞归巢到炎症部位,对溃疡性结肠炎发挥协同治疗作用。
更重要的是,他们设计了一种AAV驱动的遗传回路,仅通过单次注射即可诱导TNF-α,B7-1和整合素α4的实质性和持久抑制。总体而言,这项研究为溃疡性结肠炎建立了可行的联合治疗策略,这可能为需要两种或更多种独立化合物或抗体的常规生物疗法提供替代方案。
这项研究很重要,原因如下:
(1)多靶点遗传回路形成裸DNA质粒或AAV,仅通过静脉注射给药;然后,多个siRNA自发地同时由肝脏产生并通过小细胞外囊泡的循环系统转移。这种设计借用了人体自身的小RNA组装和运输机制,重新构思了联合治疗的策略,从而解决了溃疡性结肠炎联合治疗的瓶颈问题。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!