突变如何影响蛋白质稳定性和结构动力学对于理解疾病的分子机制和靶向药物设计至关重要。然而,探究突变引起的微妙结构动力学的分子细节仍然具有挑战性。
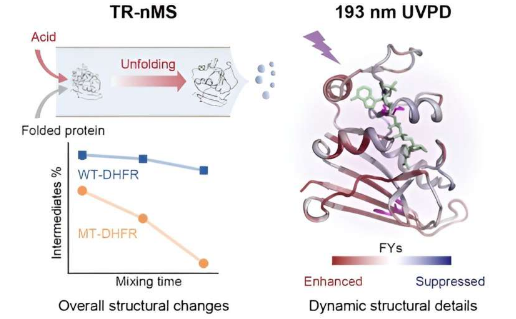
中国科学院大连化学物理研究所王方军教授课题组开发了一种结合紫外光解离(UVPD)分析的时间分辨原生质谱(TR-nMS)策略。该策略可以询问突变引起的蛋白质稳定性和结构展开动力学的微妙变化。该研究发表在《美国化学会杂志》上。
研究人员通过将蛋白质与甲酸在线混合来启动蛋白质展开过程。利用天然质谱 (nMS) 和非变性电喷雾电离 (nESI),他们通过独特的电荷态分布 (CSD) 监测酸引发蛋白质解折叠中间体的种类和相对强度,并定量表征 M42T/H114R突变诱导靶蛋白稳定性改变。
此外,研究人员采用UVPD和碎片离子质谱方法定量比较野生型二氢叶酸还原酶(DHFR)和突变体的展开中间体的动态结构和分子细节。
UVPD分析揭示了辅因子烟酰胺腺嘌呤二核苷酸磷酸(NADPH)对DHFR结构的特殊稳定作用,并且M42T/H114R突变可以减少非共价NADPH-DHFR相互作用,包括残基I41、Q65、V78、D79、I82 ,和R98,从而促进稳定性的降低。
王教授说:“这项工作为研究突变引起的微妙结构动力学和病理机制提供了一种新技术。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!