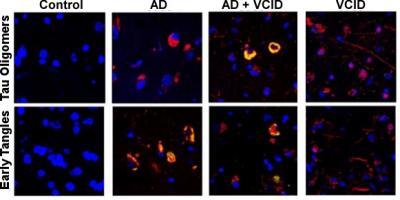
研究人员仍然对导致痴呆症的原因以及如何治疗和逆转患者的认知能力下降感到困惑。在一项同类研究中,南卡罗来纳医科大学 (MUSC) 和哈佛医学院贝丝以色列女执事医疗中心 (BIDMC) 的研究人员发现,cis P-tau,一种有毒、不可降解的一种健康的大脑蛋白质,是血管性痴呆 (VaD) 和阿尔茨海默病 (AD) 的早期标志物。他们的结果于 6 月 2 日发表在《科学转化医学》上,定义导致这种有毒蛋白质积累的分子机制。此外,他们表明,靶向这种有毒蛋白质的单克隆抗体 (mAb) 能够预防 AD 和 VaD 样临床前模型中的疾病病理和记忆丧失。此外,这种治疗甚至能够在类似 AD 的临床前模型中逆转认知障碍。
“我们相信,我们的研究结果不仅发现了 cis P-tau 作为以前未被认识的 VaD 和 AD 的主要早期驱动因素,而且还确定了一种高效且特异性的免疫疗法,以针对这种常见疾病驱动因素在早期治疗和预防 AD 和 VaD, ” MUSC 医学系心脏病学部的共同主要作者兼助理教授 Onder Albayram 博士说。
衰老是生活的正常组成部分——我们会经历骨骼和肌肉变弱、血管变硬和一些记忆力衰退。但是对于全世界大约 5000 万人来说,这些记忆力衰退变得越来越严重,最终导致痴呆症的诊断。
痴呆症是一个涵盖 AD 的总称,占病例的 60% 至 80%;VaD,第二个最常见的原因;和其他不太常见的病理。目前,对于 AD 没有有效的治疗方法。有趣的是,大多数 AD 病例都有血管成分,这表明认知功能与健康的脑血管系统之间存在更广泛的关系。更好地理解这种关系可以提供一个平台来发现新的治疗靶点。
“我们的工作提供的证据表明,顺式 P-tau 可能是解释 VaD 的致病因素,它通常与其他痴呆症无关,”BIDMC 的共同主要作者和博士后研究员 Chenxi Qiu 博士补充说,哈佛医学院。
在 VaD 的临床前模型中,年轻小鼠在一个月内表现出脑部炎症和记忆力减退的迹象。然而,用顺式 P-tau mAb 治疗这些小鼠可防止神经退化和认知能力下降长达六个月。在一个单独的 AD 临床前模型中,老年小鼠表现出严重的认知障碍。令人兴奋的是,当给小鼠服用顺式 P-tau mAb 时,这种严重的损伤得到了显着逆转。
标签: 阿尔茨海默氏症
免责声明:本文由用户上传,如有侵权请联系删除!