东京-东京城市大学的研究人员一直在量化不同批次的间充质干细胞对环境机械刚度的反应。他们着眼于某些蛋白质如何“定位”在细胞核中,并发现了这种蛋白质如何随硬度变化的关键趋势。他们的发现解释了先前发现之间的矛盾,并可能指导科学家如何控制干细胞的状态以进行研究和药物治疗。
间充质干细胞(MSC)是重要的“祖细胞”,可以转化为肌肉,软骨,骨骼或脂肪细胞。在2006年,Engler及其同事的开创性工作表明,他们可以通过简单地将它们置于具有不同机械刚度或弹性模量的表面上来控制转化(或“分化”)的细胞类型。从那时起,科学家一直在试图确切地确定这种情况如何发生。问题是,尽管该现象是可靠且可重现的,但事实证明它们对放置它们的确切环境非常敏感,即使它们来自哪一批。赌注很高:对MSC状态的可靠控制将意味着更多的研究,甚至是潜在的生物医学应用。
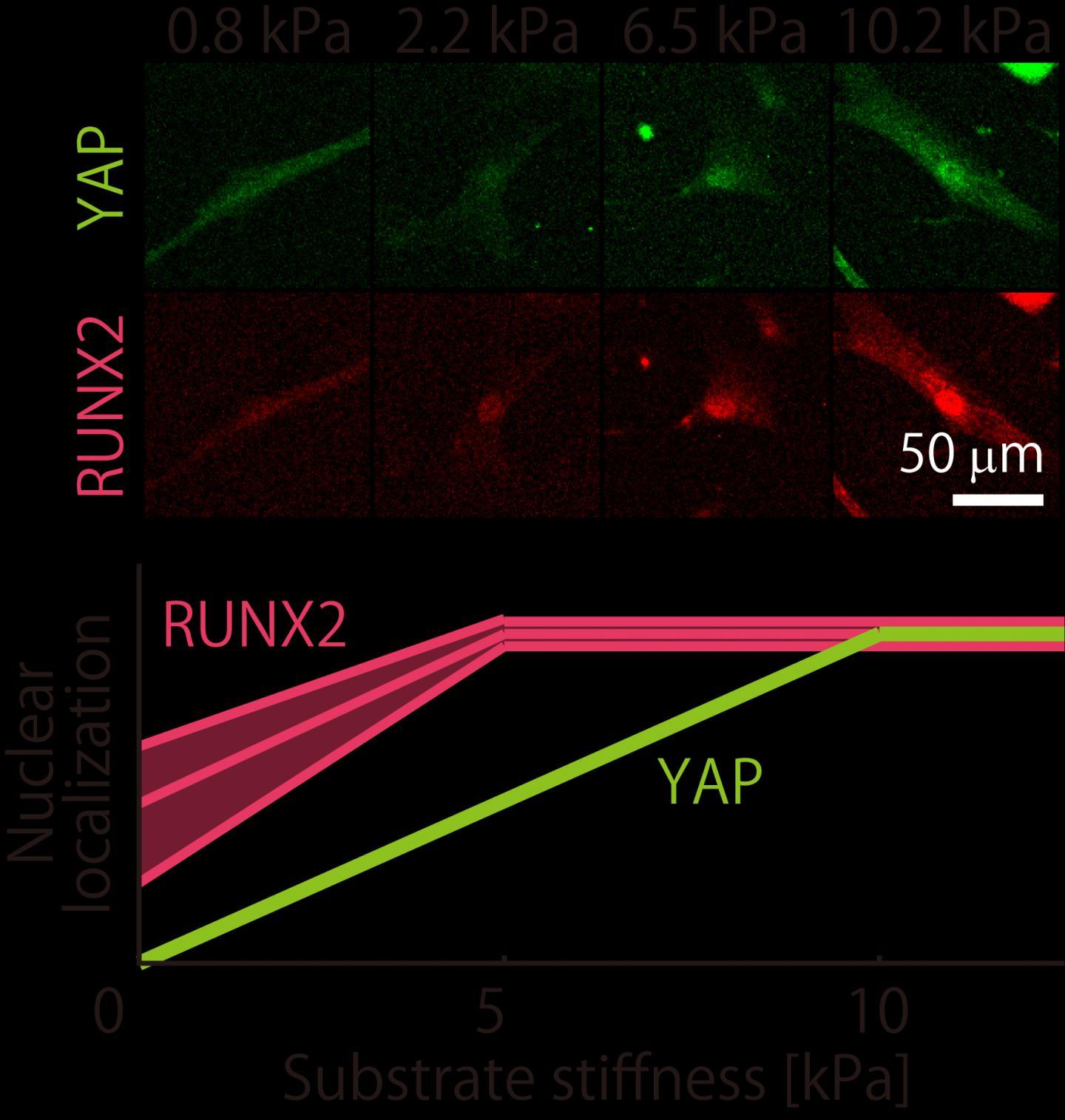
这项搜索激发了由东京都大学副教授Hiromi Miyoshi领导的一个团队,研究了不同批次的MSC如何响应不同的环境。他们着重研究了MSC中存在的两种蛋白,YAP蛋白和RUNX2,后者是帮助细胞转化为成骨细胞并最终成为骨骼的材料,它可以帮助细胞对机械环境做出反应。他们研究了不同批次的MSC在其细胞内如何具有不同的YAP和RUNX2分布。对于他们的“僵硬”环境,他们选择了一种特殊设计的明胶底物,该底物的再现性比流行的胶原蛋白替代品好得多。
从一开始,他们就发现批次非常不同。在基本的实验中,研究了它们如何转变为造骨或造脂细胞,他们发现这些批次产生的钙和脂肪沉积量差异很大。但是当谈到他们的机械响应行为时,事实证明他们并没有最初想象的那么疯狂。首先,研究小组发现,在细胞核中发现的YAP比例(或“定位”)在批次之间以一致的方式变化,并在相同的硬度下达到平稳。对于RUNX2,尽管定位有所不同,但它们仍然稳定在特定的刚度值(与YAP不同)。即使这样,RUNX2本地化的趋势一直到线性。
有了这种信息,任何人都可以制造出具有特定硬度的凝胶,并主动控制间充质干细胞核中YAP / RUNX2的水平。这样,他们可以调整细胞分化的时间和方式。研究小组希望对细胞命运的这种新的控制水平将有助于加速对MSC的研究,并有可能导致治疗应用。
标签: 触感
免责声明:本文由用户上传,如有侵权请联系删除!