当阿尔茨海默氏病发作时,整个大脑不会立刻崩溃。相反,头脑像严峻的发条一样瓦解,首先是内嗅皮层中一组脑细胞的明显退化。这些所谓的易受攻击的神经元负责将穿梭经历转移到记忆中。他们永远是第一个去的。
弄清楚为什么患者早期会失去这些脆弱的神经元可能是发现阿尔茨海默氏症新疗法的关键。现在,一项新的研究揭示了神经元这一子集的内部工作原理,并描述了使内嗅脑细胞对变性独特敏感的分子因素。
保罗·格林加德已故分子和细胞神经科学实验室的高级研究员让-皮埃尔·鲁萨里(Jean-Pierre Roussarie)说:“如果我们能够了解大脑最脆弱的神经元的特殊性,我们就有可能开辟新的治疗途径。”在神经元中。
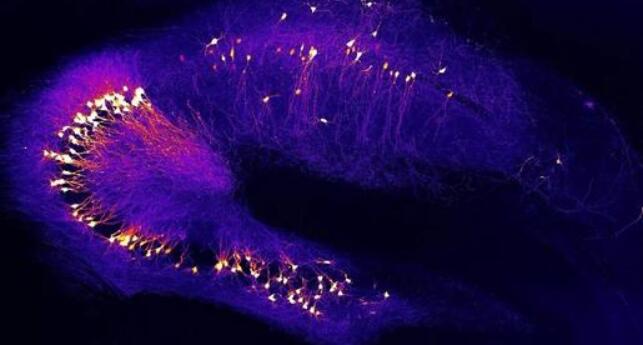
“大脑的糊状的碗”
到目前为止,开发治疗阿尔茨海默氏病的尝试在很大程度上失败了。但是,大多数努力集中在积累A?肽,在整个大脑中形成斑块。这些斑块是阿尔茨海默氏症的第一个迹象,也是研究最多的迹象。
该病的第二种症状较少受到欢迎,但可能抱有更多希望。最初的淀粉样蛋白斑块在大脑中形成后,一堆名为神经原纤维缠结的tau蛋白堵塞了神经元内部。与淀粉样蛋白斑块不同,后一种蛋白团簇最初仅在内嗅皮质的一组不同细胞内聚集。该过程的绝对可预测性使其成为有吸引力的治疗靶标。
但是直到现在,科学家对使脆弱神经元滴答作响的细微差别还知之甚少。考虑到这一点,研究人员着手对遗传因子进行分类,这些遗传因子使内嗅神经元唯一易受神经原纤维缠结的伤害。
Roussarie说:“已经进行了一项又一项的试验,我们对产生淀粉样斑块的机制有了广泛的了解。”“但是淀粉样蛋白沉积下游发生的事情,以及这些斑块如何触发脆弱神经元内的神经原纤维缠结,更是一个难题。在这里我们可以发现新的治疗靶标。”
研究这些脑细胞的最大障碍是缺乏任何容易的方法来区分脆弱的神经元与其邻居。对于Roussarie及其同事,BacTRAP提供了答案。bacTRAP技术由Greengard和Nathaniel Heintz在洛克菲勒开发,bacTRAP技术可以对小鼠特定神经元群体内的蛋白质进行分类。
实验室的负责人,这项研究的共同作者马克·弗拉霍莱特(Marc Flajolet)说:“我们需要从复杂而糊状的大脑碗中对这些神经元进行显微解剖。”
BacTRAP使研究人员能够分离出脆弱的神经元,并从遗传上分析它们与更具韧性的脑细胞之间的差异。由奥尔加·特罗扬斯卡亚(Olga Troyanskaya)领导的普林斯顿大学团队随后设计了计算机算法,以帮助该团队仅关注可能与神经变性最相关的遗传异常。
Flajolet说:“目标是形成全局视图,而不是基因列表。”“只有借助这些复杂的数据分析框架,您才能深入了解像阿尔茨海默氏病中神经退行性级联反应一样复杂的事物。”
从神经原纤维缠结到治疗目标
这些发现突出了一组可能与使内嗅皮质神经元成为变性目标的基因有关。
据认为,其中最引人注目的是在阿尔茨海默氏症的早期阶段起主要作用-首先决定tau蛋白是否会聚集成神经原纤维缠结。该基因产生一种叫做PTBP1的蛋白质,一种所谓的剪接因子,它指导细胞产生tau蛋白的两种亚型之一。先前的研究表明,阿尔茨海默氏症的特征性蛋白质团块是在两种tau风味的比例被破坏时特别发生的-新发现表明该疾病可能是由tau变异水平受到干扰的细胞驱动的。
赖斯大学计算机科学助理教授,《神经元报告》的合著者姚伟(Vicky Yao)说:“当tau突然出现时,人们会非常兴奋。”“一旦我们弄清了使神经元更容易受到伤害的原因,就会导致多种途径来减少它们的脆弱性。”
Roussarie补充说,成功的预防和治疗神经变性的策略可能涉及多种方法。例如,未来的药物可能需要靶向斑块配方以及神经原纤维缠结,而预防后者的第一步将是首先了解使某些神经元易于缠结的原因。
Roussarie说:“以前没有考虑过神经元的多样性。”“很多人正在研究神经原纤维缠结,但是直到现在,我们才开始通过神经元脆弱性来解决它。”
标签:
免责声明:本文由用户上传,如有侵权请联系删除!