UT 西南大学和华盛顿大学的研究人员领导了一个国际团队,该团队使用人工智能 (AI) 和进化分析来生成真核蛋白质相互作用的 3D 模型。这项发表在《科学》杂志上的研究首次确定了 100 多种可能的蛋白质复合物,并为 700 多种以前未表征的蛋白质复合物提供了结构模型。深入了解蛋白质对或蛋白质组结合在一起以进行细胞过程的方式可能会导致大量新的药物靶点。
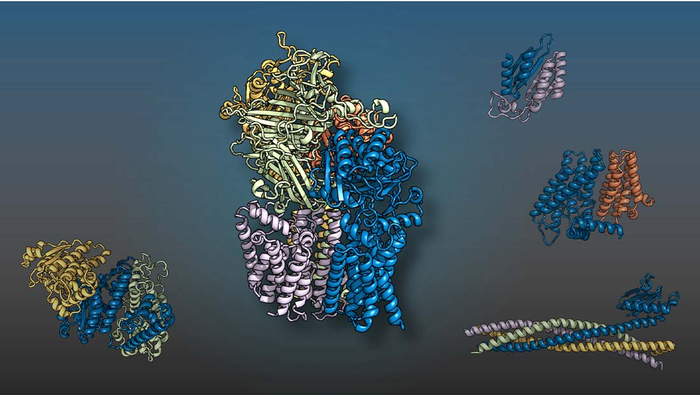
“我们的结果代表了结构生物学新时代的重大进步,计算在其中发挥着重要作用,”尤金麦克德莫特人类生长与发展中心助理教授、生物物理学副教授钱聪博士说.
在被 UT Southwestern 招募之前,Cong 博士与华盛顿大学生物化学教授兼博士后导师 David Baker 博士一起领导了这项研究。该研究有四位共同主要作者,包括 UT 西南计算生物学家 Jimin Pei,博士。
Cong 博士解释说,蛋白质通常成对或成组运作,称为复合物,以完成保持生物体存活所需的每一项任务。虽然其中一些相互作用得到了很好的研究,但许多仍然是个谜。构建全面的相互作用组——或细胞中完整的分子相互作用集的描述——将阐明生物学的许多基本方面,并为研究人员开发鼓励或阻止这些相互作用的药物提供一个新的起点。丛博士在新兴的相互作用组学领域工作,该领域结合了生物信息学和生物学。
直到最近,构建相互作用组的一个主要障碍是许多蛋白质结构的不确定性,这是科学家半个世纪以来一直试图解决的问题。2020 年和 2021 年,一家名为 DeepMind 的公司和 Baker 博士的实验室独立发布了两种 AI 技术,称为 AlphaFold(AF)和 RoseTTAFold(RF),它们使用不同的策略根据产生蛋白质的基因序列来预测蛋白质结构。
在当前的研究中,Cong 博士、Baker 博士和他们的同事通过对许多酵母蛋白质复合物进行建模来扩展这些 AI 结构预测工具。酵母是基础生物学研究的常见模式生物。为了找到可能相互作用的蛋白质,科学家们首先在相关真菌的基因组中搜索了以相关方式获得突变的基因。然后他们使用这两种人工智能技术来确定这些蛋白质是否可以组合成 3D 结构。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!