改进的基因编辑方法可以为下一代细胞和基因疗法提供动力
与现有方法相比,细胞基因工程的新方法有望显着提高速度,效率和降低细胞毒性。根据宾夕法尼亚大学佩雷尔曼医学院研究人员的一项研究,这种方法还可以推动癌症和其他疾病的先进细胞疗法的开发。
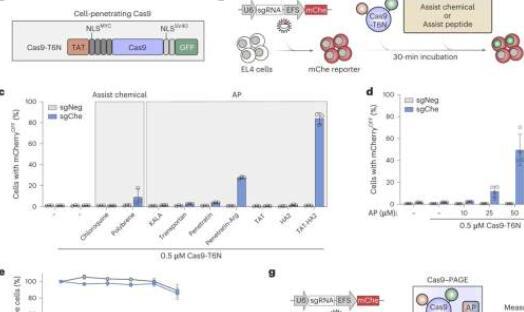
在本周发表在《自然生物技术》杂志上的这项研究中,研究人员发现,一些病毒用来帮助它们进入细胞的蛋白质片段也可用于将CRISPR-Cas基因编辑分子带入细胞及其含有DNA的细胞核中,具有非常高的效率和低细胞毒性。
科学家们预计,这项新技术对于修饰患者自身体内的T细胞和其他细胞以制造细胞疗法特别有用。其中一种应用可能是CAR T(嵌合抗原受体T细胞)疗法,它使用来自患者的特殊修饰免疫细胞来治疗癌症。T细胞(一种白细胞)从患者身上取出并重新编程,以便在重新引入血液时发现和攻击癌细胞。
第一个FDA批准的CAR T疗法是在Penn Medicine开发的,并于2017年获得食品和药物管理局的批准。美国现在有六种FDA批准的CAR-T细胞疗法。这些疗法彻底改变了某些B细胞白血病,淋巴瘤和其他血癌的治疗,使许多原本希望渺茫的患者长期缓解。
“这种新方法 - 基于Penn Medicine的细胞和基因治疗创新历史 - 有可能成为工程细胞疗法的主要使能技术,”共同资深作者E. John Wherry博士,Richard和Barbara Schiffrin总统杰出教授和宾夕法尼亚医学院系统药理学和转化治疗学主席说。
CRISPR-Cas分子来源于古老的细菌抗病毒防御,旨在精确去除细胞基因组中所需位置的DNA。一些基于CRISPR-Cas的系统将旧DNA的缺失与新DNA的插入相结合,以实现多功能基因组编辑。这种方法可用于用校正的基因替换有缺陷的基因,或删除或修改基因以增强细胞功能。一些系统还可以添加赋予CAR-T细胞新特性的基因,例如识别肿瘤或承受通常耗尽T细胞的恶劣肿瘤微环境的能力。
尽管CRISPR-Cas系统已经被广泛用作分子生物学的标准实验室工具,但它们在修饰患者细胞以制造基于细胞的疗法方面的应用受到限制 - 部分原因是CRISPR-Cas分子很难进入细胞,然后进入细胞的含DNA细胞核。
“目前将CRISPR-Cas系统带入细胞的方法,包括使用载体病毒和电脉冲,对于直接从患者身上取出的细胞(称为原代细胞)效率低下。这些方法通常还会杀死它们使用的许多细胞,甚至可能导致基因活性的广泛不必要的变化,“共同资深作者Shelley L. Berger博士说,他是Daniel S. Och大学细胞和发育生物学和遗传学教授,宾夕法尼亚大学表观遗传学研究所所长。
在这项研究中,研究人员探索了使用小的病毒衍生蛋白质片段(称为肽)来更有效地引导CRISPR-Cas分子通过原代人体细胞的外膜并进入其细胞核。值得注意的是,研究人员发现,两种修饰肽的融合组合 - 一种在HIV中发现,一种在流感病毒中发现 - 可以与CRISPR-Cas分子混合,使它们进入原代人或小鼠细胞及其细胞核,效率高达近100%,具体取决于细胞类型 - 几乎没有毒性或基因表达变化。
该团队展示了这种方法,他们称之为PAGE(肽辅助基因组编辑),用于几种类型的设想细胞疗法,包括CAR T细胞疗法。
除了在细胞和基因治疗中的潜在用途外,作者还指出,PAGE方法可以在基础科学研究中看到广泛的应用。标准CRISPR-Cas细胞渗透方法的低效率意味着基因编辑来创建小鼠疾病模型通常需要一个多步骤,耗时的产生转基因小鼠的过程 - 将基因编辑机制引入其DNA中。相比之下,PAGE具有高效率和低毒性,可以在普通实验室小鼠中实现快速,高效和直接的基因编辑。
“肽辅助概念的简单性和强大性表明,它有可能在未来用于将其他基因组编辑蛋白甚至基于蛋白质的药物递送到原代细胞中,”共同资深作者Junwei Shi博士说,他是癌症生物学助理教授,宾夕法尼亚大学表观遗传学研究所和艾布拉姆森家庭癌症研究所的成员。
这项研究是一项合作,包括宾夕法尼亚大学合著者Rahul Kohli,医学博士,博士,传染病,生物化学和生物物理学副教授,以及共同作者Gerd Blobel,医学博士,博士,Frank E. Weise III儿科教授和表观遗传学研究所联合主任的实验室。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【关于张起灵身世年龄介绍】在《盗墓笔记》系列小说中,张起灵是一个神秘而重要的角色,他的身世和年龄一直是...浏览全文>>
-
【关于张檬简介】张檬,中国内地女演员及歌手,1987年4月20日出生于山东省青岛市。她自出道以来,凭借扎实的演...浏览全文>>
-
【关于张謇的资料】张謇(1853年—1926年),字季直,号啬庵,江苏通州(今南通市)人,是中国近代著名的实业...浏览全文>>
-
【关于张家界百龙天梯的介绍】张家界百龙天梯位于湖南省张家界市武陵源风景名胜区,是世界上最高的户外电梯,...浏览全文>>
-
【关于张籍的资料】张籍(约766年-约830年),字文昌,是唐代著名诗人之一,与韩愈同为“古文运动”的重要人...浏览全文>>
-
【关于张海迪故事简介】张海迪,中国著名作家、残疾人代表,被誉为“中国的保尔·柯察金”。她自幼因病导致高...浏览全文>>
-
【关于张海迪的资料】张海迪是中国著名的残疾人作家、社会活动家,被誉为“中国保尔·柯察金”。她自幼因病导...浏览全文>>
-
【关于张飞的五个小故事】张飞是三国时期蜀汉的重要将领,与关羽并称“万人敌”,以勇猛、豪爽著称。在《三国...浏览全文>>
-
【关于张飞的故事】张飞是三国时期蜀汉的重要将领,与刘备、关羽并称“刘关张”,在《三国演义》中被描绘为勇...浏览全文>>
-
【关于鱼肉粥的做法】鱼肉粥是一道营养丰富、口感细腻的家常美食,尤其适合老人、小孩和病后恢复期的人群食用...浏览全文>>
