Dana-Farber 癌症研究所的研究人员今天在Science Signaling上发表的一项研究报告说,一种在新收集的人类肿瘤细胞中筛选数千种药物的新方法可以帮助确定哪些药物最有可能对这些癌症有效。
由于该技术使用的肿瘤细胞不到一天前还存在于患者体内,因此它很可能比传统的药物筛选方法更准确,后者使用的实验室细胞模型可能与患者体内的细胞模型相差数周甚至数年,研究作者说。它的使用可以提高医生对个体患者进行个性化治疗的能力,并帮助科学家发现新药可以靶向的癌细胞中的弱点。
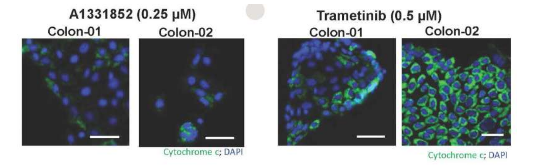
“长时间培养的癌细胞可能会发生各种变化,可能无法代表小鼠或人类中实际存在的肿瘤细胞,”该研究的第一作者 Patrick Bhola 博士说。 -法伯。“挑战在于创造一种药物筛选技术,缩小体内肿瘤细胞与我们进行筛选的细胞之间的差距。我们开发的技术有助于实现这一目标。”
这项技术被称为高通量动态 BH3 分析 (HT-DBP),是 Dana-Farber 研究人员创建的一项测试的放大版本,该测试可衡量肿瘤细胞在接受抗癌药物治疗后离死亡有多近。在这种情况下,死亡被定义为细胞凋亡——细胞为响应 DNA 损伤和许多癌症治疗而启动的自毁机制。
当许多化学疗法应用于癌细胞时,它们会改变线粒体中促死亡和抗死亡分子的平衡——这种结构以向细胞提供能量而闻名。一旦促死亡分子的活性超过抗死亡分子的活性,线粒体就会释放出破坏癌细胞的有毒物质。为了确定细胞离凋亡边缘有多近,科学家们称之为“凋亡启动”的特性,研究人员将促死亡蛋白片段添加到线粒体中,并直接测量有毒蛋白的释放。这些段被称为 BH3 域,因此称为“动态 BH3 分析”或 DBP。
当药物作用于患者的癌细胞时,DBP 会指示药物是否以及在多大程度上开启促死程序。在用特定药物治疗后显示凋亡启动显着增加的肿瘤细胞很可能在实验室和患者体内对该药物产生反应。
第一版 DBP 的优点之一是它可以快速生成结果——在许多情况下不到一天。但它受到一次只能筛选 10-20 种药物的能力的限制——考虑到现在有无数种药物可用于治疗多种癌症,这是一个重大的限制。Dana-Farber 的研究人员与麻省理工学院和哈佛大学 Broad 研究所以及哈佛医学院系统药理学实验室的同事一起对 DBP 进行小型化和自动化,以便它可以筛选成百上千种药物,从而创建高通量 (HT) 模型技术。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!