在日本,自1981年以来,癌症一直是导致死亡的主要原因。目前,手术、化疗和放疗是主要的治疗选择。然而,这些治疗大大降低了术后生活质量;因此,非常需要开发新的治疗方法。
光动力疗法(PDT)是一种新的治疗方法,由于其比其他治疗方法侵入性更小而受到关注。在 PDT 中,首先将光敏剂注入体内。然后,将患病区域暴露在光线下,诱导该区域的光敏剂发生光化学反应。这会产生活性氧(ROS),从而破坏癌细胞。
为了提高 PDT 的性能,深入了解光敏物质在细胞中特异性积累的机制以及 ROS 如何有效地仅杀死癌细胞至关重要。
研究人员重点介绍了一种最近开发的光敏剂——多脂蛋白(PLP),以其高治疗功效而闻名。然而,PLP 有效性的潜在机制仍不清楚。
研究小组使用共焦超分辨率显微镜,研究了 PDT 与 PLP 对两种细胞系的有效性:正常大鼠胃上皮细胞系 RGM1 和胃粘膜来源的癌症样突变体 RGK1(同源癌细胞)。
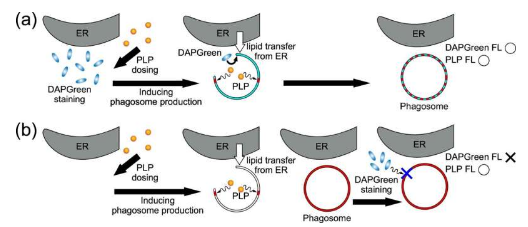
发表在《通讯生物学》上的研究结果表明,PLP 积聚在细胞内囊泡(称为吞噬体)的膜中。它们是在自噬机制的早期产生的,自噬机制会降解并重新利用细胞中的外来物质和蛋白质。
当快速增殖的癌细胞挨饿时,自噬机制就会开始进行。PDT应用后,RGK1细胞中的吞噬体膜破裂,释放出水解酶和ROS,以及其自身细胞质成分(如蛋白质、脂质)和细胞器(如线粒体和内质网)分解产生的物质。这些物质扩散到细胞内,从而导致细胞坏死。相比之下,在 RGM1 中,小吞噬体合并形成大吞噬体而不破裂。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!