用于干细胞疗法的辅助试剂
干细胞疗法有治疗数种病症的巨大潜能,其中包括帕金森病、糖尿病和心脏病。干细胞疗法市场正处于发展阶段,而且会有越来越多的疗法涌现并用于临床。这就引发了对细胞疗法制造工艺中所用辅助试剂 (AM) 的质量和适用性的讨论。在许多情况下,可用的 AM 仅能按适于科研和临床前工作的质量标准进行生产,因此需要对其在临床开发中的适用性进行谨慎的风险评估。
AM 是用于细胞疗法生产工艺中的试剂,但不会在成品中检测到。它们包括用于重新编程、延伸和分化过程等干细胞培养的试剂。小分子和生长因子就是此类 AM 的示例。尽管 AM 不会在成品中检测到,但它们确实会影响成品的质量,从而影响安全性、纯度,进而影响最终细胞产品用于临床的适用性。
仔细验证 AM 是否适用于整个干细胞疗法生产工艺很重要。应将重点放在降低细胞疗法带给患者安全风险上,重要的是,此博文的一部分旨在挑选正确且最适合在疗法开发的不同阶段使用的 AM。
小分子用作辅助试剂
与用于干细胞疗法生产的其他辅助试剂相比,小分子具有许多优势。
由于小分子可通过人工合成生产,因此其纯度较高且批次间差异较小,从而确保活性一致且结果可重复
小分子的作用机理是可逆的, 这在小分子的作用仅在特定时间段才需要时显得尤其重要
由于是人工合成的,所以小分子无动物成分,这就消除了不需要的基因材料进入您工艺的风险
小分子的生产规模很容易扩大,因此当细胞疗法进入临床时,生产大量的试剂不成问题。
针对辅助试剂使用的监管
在干细胞疗法开发过程中,始终要优先考虑患者的安全,同时监管机构可能会询问如何降低使用 AM(作为生产工艺的一部分)所带来的风险。在进入临床之前,需谨慎验证一种 AM 的适用性,从而避免由于监管机构的反馈而不得不替换 AM,这样必然会导致大量的时间和金钱损失。
辅助试剂 合格性
您如何知晓您的 AM 是否适用于干细胞生产?
辅助试剂应根据来源、纯度、特性、安全性和适用性来进行验证。如果在这些因素未知的情况下使用某种 AM,则可能需要进行广泛且昂贵的资格验证来确保您所选的 AM 适用且不会损害最终的细胞疗法。
如果您要将某种小分子用作 AM,那么 ICH 和 USP 可提供公认的标准:ICH Q7,“活性药物成分的生产质量管理规范”;和 USP <1043>,“细胞、基因及组织工程产品的辅助试剂”。
USP1043 用于细胞疗法产品的辅助试剂
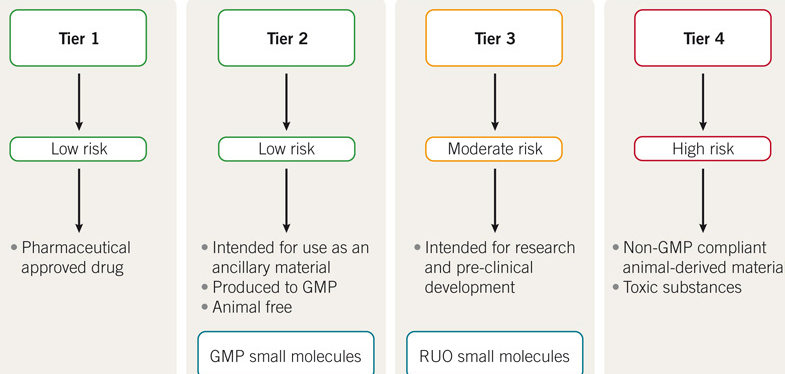
图 1:USP <1043>“细胞、基因与及组织工程产品的辅助试剂”的图解。GMP 小分子对最终细胞疗法的风险较低,所以适用作 AM;而 RUO 小分子有中等风险,因此不适于用作 AM。
从 RUO 辅助试剂转换成 GMP 辅助试剂
您会在什么时候期待将 RUO 试剂转换成 GMP 试剂?
尽管 RUO 试剂可用于临床前研发,但较早使用 GMP AM 可能使研发过程更容易并经济划算。这是因为将 RUO 试剂转换为 GMP 试剂需要进行验证和优化研究,以此确保工艺保持一致。在细胞疗法即将进入临床时更换试剂会需要进行昂贵的对比研究,而且比起早期的 GMP 试剂验证,审查会更严格。在将细胞疗法推向临床时通常会面临巨大的时间压力,此时的验证研究还很耗时,会导致延期。
在开发过程早期使用 GMP 材料无需进行随后的对比研究,从而节省了时间和金钱,并确保了从临床前到临床试验的更佳衔接。
接下来的步骤
所以,接下来要做什么呢? 在早期的研发过程与您的供应商合作,以验证您所需的 AM 并确保 AM 满足监管需求。选择一个 GMP 供应商是明智的,这可减少对大量资格验证的需求并可轻松地从临床前过渡至临床。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!