全世界有超过 4000 万人患有 1 型糖尿病 (T1D),这是一种自身免疫性疾病,其中胰腺中产生胰岛素的 β 细胞被免疫系统破坏。今天,有几种新兴的 1 型糖尿病治疗方法,包括宏封装装置 (MED)——设计用于容纳和保护胰岛素分泌细胞的隔室。就像骑士周围的盔甲一样,MED 保护其中的细胞免受攻击(来自宿主免疫系统),同时允许营养物质进出,以便细胞能够继续生存。但 MED 有几个限制,扩大此类设备用于人类一直具有挑战性。来自布莱根妇女医院的一组研究人员与哈佛大学和马萨诸塞大学医学院的同事合作设计了一种对流增强型 MED (ceMED),它可以持续为细胞提供所需的营养并提高细胞负载能力,同时提高细胞存活率、葡萄糖敏感性和适时性胰岛素分泌。在临床前模型中,ceMED 在植入后两天内迅速对血糖水平做出反应。结果发表在《美国国家科学院院刊》上。
“由于最近的进展,我们越来越接近拥有无限来源的 β 样细胞,这些细胞可以通过分泌胰岛素对葡萄糖作出反应,但下一个挑战是以微创和将具有最大功能的寿命,”通讯作者、临床麻醉学、围手术期和疼痛医学首席研究员兼特聘主席杰夫卡普博士说。“我们的设备在移植后表现出增强的细胞活力和最小的延迟。这是该系统强大的临床前概念证明。”
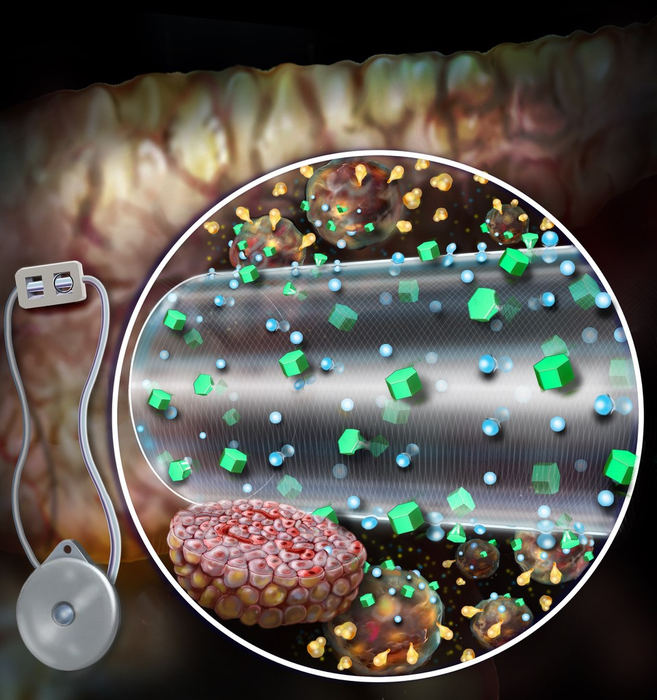
当前的 MED 是扩散依赖性的——营养物质通过装置的外膜扩散,只有一些细胞可以接受营养物质和氧气,进而分泌胰岛素。ceMED 旨在通过连续流体流向封装细胞提供对流营养,使多层细胞能够生长和存活。该团队的原型具有两个室 - 一个平衡室 (EqC) 从周围收集营养物质,以及一个容纳受保护细胞的细胞室 (CC)。EqC 被封闭在聚四氟乙烯中——一种带孔的半透膜,允许流体进入。围绕 CC 的额外内膜选择性地允许营养物质运输并防止免疫反应。灌注的液体流过多孔中空纤维,以与植入物周围组织相似的营养浓度到达 CC。中空纤维允许胰岛素和葡萄糖自由通过,但不允许其中可能攻击封装细胞的关键免疫分子。
“干细胞衍生胰岛用于治疗自身免疫性或 1 型糖尿病的应用现在已经转向寻找一种方法来保护细胞免受免疫排斥并在移植后最大限度地提高它们的存活率和功能,”合著者道格梅尔顿说,哈佛干细胞研究所干细胞与再生生物学系博士。“对流增强宏封装很可能是实现所有这些目标的可行方法。”
与传统胰岛素泵相比,该设备具有许多优势,允许细胞按需分泌胰岛素,并在血糖水平下降时迅速停止分泌胰岛素。在 1 型糖尿病的啮齿动物模型中,ceMED 增强了细胞的存活率和胰岛素分泌,并且早在移植后两天就开始降低血糖水平。
“ceMED 设备有可能成为一个自主系统,不需要不断地重新填充和更换胰岛素盒,”主要作者 Kisuk Yang 博士说,他曾是卡普实验室的博士后研究员,现在是卡普实验室生物工程系的教员。韩国仁川国立大学。
“由于它的响应能力,这种设备和新颖的流量增强方法可能对‘脆性’糖尿病患者特别有用,他们的糖尿病导致血糖水平不可预测的波动,”Eoin O'Cearbhail 博士(现就读于都柏林大学学院)补充道。 ,爱尔兰),他是在卡普实验室担任博士后研究员期间帮助发展这一概念的合著者。该团队指出了将设备推向临床所需的未来方向,包括扩大细胞负载能力和优化供人类使用的灌注流动系统。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!