发表在Oncoscience上的一项新研究观点探讨了 SLFN11 在蛋白质稳态中的监测作用。
内质网(ER) 是在真核生物中产生功能性蛋白质的细胞器。然而,增加的蛋白质合成通常会导致蛋白质错误折叠,从而导致 ER 应激和未折叠蛋白质反应 (UPR) 的相互激活。泛素蛋白酶体系统 (UPS) 和 ER 应激相关蛋白降解 (ERAD) 途径可去除未成熟的蛋白质。
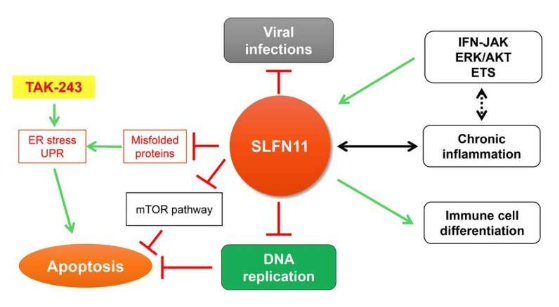
最近,来自弘前大学医学研究生院和国立癌症研究所的这一研究观点的作者(Yasuhisa Murai、Ukhyun Jo、Yasuhiro Arakawa、Naoko Takebe 和 Yves Pommier)证明 Schlafen11 (SLFN11) 是一种监测因子通过减轻源自蛋白质合成和成熟的蛋白质毒性应激来实现蛋白质稳态。
Schlafen(德语中的“睡觉”)是一个基因家族的名称,包括人类细胞中的 SLFN5、SLFN11、SLFN12、SLFN12L、SLFN13 和 SLFN14。在 SLFN 家族中,SLFN11 已被确定为针对多种癌症类型的 DNA 复制的抗癌药物的细胞毒性的关键决定因素。SLFN11 在复制压力下被招募到受损的复制叉上。它通过促进 Cdc45-Mcm2-7-GINS (CMG) 解旋酶复合物的不稳定、降解染色质许可和 DNA 复制因子 1 (CDT1)、重塑染色质和诱导早期基因来不可逆地抑制复制。它在约 50% 的癌细胞中缺乏表达导致化学抗性。
“SLFN11 在抑制病毒感染和肿瘤发生方面也发挥着关键作用。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!