蛋白质是由称为氨基酸的较小成分组成的长聚合物,在人体机能中起着至关重要的作用。在人类的一生中,这些蛋白质“串”折叠成独特的 3D 结构或构象,这种折叠过程会影响大脑中不同通道和受体与其他蛋白质的相互作用。
随着人类年龄的增长,基因突变和环境因素会导致蛋白质的错误折叠。现在已知神经退行性疾病,如阿尔茨海默病和帕金森病,是由蛋白质的错误“折叠”引起的。
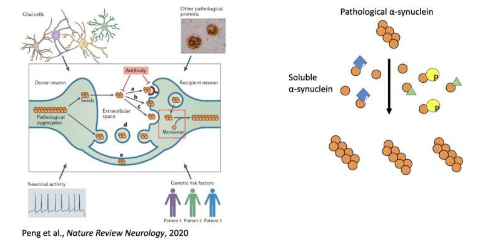
加州大学洛杉矶分校 (UCLA)、宾夕法尼亚大学以及美国和中国其他研究所的一组研究人员最近发现了一种调节病理蛋白——错误折叠的 α-突触核蛋白——的传递的机制,该蛋白已被发现与帕金森病的进展有关。发表在《自然神经科学》(Nature Neuroscience)上的一篇论文概述了这种机制,包括细胞可以对这些蛋白质进行的一系列改变,从而影响它们在大脑中传播的能力。
“这篇论文的整个想法是在我为该领域撰写评论时形成的,我在这篇文章中总结了所有已知的病理蛋白质传播机制,”进行该研究的研究人员之一彭超告诉 Medical Xpress。
“在我写这篇文章时,我注意到目前对病理性蛋白质传递的研究主要集中在病理性蛋白质或‘种子’上。然而,病理蛋白的成功传播不仅需要病理蛋白(种子),还需要相应的正常可溶性蛋白(底物)。”
大多数过去专注于蛋白质和神经退行性疾病的神经科学研究没有探索可溶性蛋白质可能调节病理蛋白质扩增的机制。Peng 和他的同事最近工作的主要目标是研究这些影响,特别关注蛋白质 α-突触核蛋白 (a-syn),该蛋白在错误折叠时与帕金森病的进展有关。
“在 a-syn 上发现了许多翻译后修饰 (PTM),其中许多也在可溶性 a-syn 上发现,”Peng 说。“因此,我们决定测试可溶性 a-syn PTM 是否会调节病理性 a-syn 的扩增。因此,我们开发了一种基于细胞的检测方法,可用于模拟细胞中的这种扩增过程。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!