在会议之前,FDA对临床试验期间使用tau PET成像、淀粉样蛋白清除后停止给药以及服用抗血栓药物的患者脑出血的小风险是否超过益处表示担忧。
FDA提出的质疑
问题1:Tau生物标志物的重要性
FDA 提出的第一个问题:使用PET成像来确定哪些患者在研究期间可能会进展。患者必须在这些扫描中显示tau的存在才能被纳入。礼来公司使用这一标准,根据低/中tau和总体参与者来划分人群。礼来公司认为,由于高tau蛋白患者的疾病会更严重,因此可能更难辨别治疗效果。尽管在试验中使用了这种方法,但礼来公司并未建议将tau扫描包含在处方信息中。FDA似乎对礼来将tau蛋白非常低或没有tau的患者排除在研究的对照部分之外,并优先考虑中低组提出了质疑。
礼来回应表示:
tau PET成像的科学使临床试验申办者能够选择认知障碍较轻的患者,在这些患者中,干预可能更有益。在过去的3年中,AD 开发计划已经从仅根据临床症状招募患者发展到现在根据确认的淀粉样蛋白病理学的存在招募患者。
因此,礼来使用这种成像策略来确保治疗组在疾病负担方面保持良好的平衡,增加研究确定治疗效果的可能性,进一步提高该领域对阿尔茨海默氏症的科学理解,并对临床试验范式进行创新,并加速未来疗法的开发。
礼来公司并不打算将tau负荷作为现实世界中患者的选择标准,因为无论tau水平如何,donanemab都有望获益,如临床试验所示,并且tau测试不是临床试验之外的标准做法。
最后,tau水平不能预测疾病进展,也不能预测药物反应,而评估淀粉样蛋白的存在对于确定药物效果至关重要。
问题 2:停药对AD患者的影响
FDA提出的第二个问题:患者是否需要在PET扫描中检测到的淀粉样蛋白达到一定清除率后停止使用donanemab治疗。试验表明分别有17%、42%和60%的患者在第24、52和76周达到阈值后停止治疗。
礼来表明:
主要终点的治疗效果具有统计学意义,与安慰剂相比,在低/中 tau人群和总体人群中,患者的iADRS下降幅度较小。
有证据表明,一半的患者在第52周时达到了与治疗相关的淀粉样蛋白清除率。治疗后,患者淀粉样蛋白缓慢恢复,但在停药6个月后12个月内无反弹。18个月时也看到了早期淀粉样蛋白清除的显著疗效。
这种方案虽然是阿尔茨海默氏症领域的新疗法,但用于长期终身治疗,可以帮助减轻治疗负担。礼来公司承认,该试验没有测试给药方案,一些患者在某一时刻停止,而另一些患者则继续,但表示这将是一项大规模且昂贵的试验。然而,AACI研究(Donanemab的3期 TRAILBLAZER-ALZ 2 试验)中展示的具有统计学意义和临床意义的疗效结果反映了这种个性化方法的实施,因此应该为这种方法适用性具有信心。
问题3:Donanemab的安全性
在安全性方面,FDA提出了Donanemab的竞争对手,Biogen和卫材的Leqembi持有淀粉样蛋白相关成像异常(ARIA)的黑框警告,这是这类药物的主要关注点。ARIA可能表明存在脑出血或肿胀的风险。AACI中的donanemab组的至少三例。有两种类型的ARIA,水肿 (ARIA-E) 和含铁血黄素沉积 (ARIA-H),分别是大脑肿胀和出血。ARIA通常是无症状的,并随着时间的推移而消失,但是,在极少数情况下,它可能很严重并导致死亡。礼来公司报告的患者群体不良事件发生率为5%,其中25%出现ARIA-H微出血,24%出现ARIA-E,15%出现ARIA-H浅表性铁质沉着症(脑出血的并发症),13%出现头痛。FDA表示,在礼来的试验期间,对非阿司匹林抗血栓药物的使用有限,这意味着无法得出与donanemab相关的这些事件的实际风险的结论。
礼来公司表示:
将积极捍卫donanemab的安全性,Donanemab已在2802名患者中进行了测试,这是任何淀粉样蛋白靶向疗法中纳入人群最多的临床试验之一。除了已知的ARIA的类别风险和低致命事件频率(0.3%)之外,没有证据表明与donanemab相关的死亡或超额死亡风险增加。
以下为FDA提出的问题汇总,这将在6月10日的会议上进行讨论:
现有数据是否提供了donanemab治疗阿尔茨海默病有效性的证据,以及基于tau PET成像的各亚组的有效性是否得到支持。
临床研究中使用的给药方案,基于PET成像上淀粉样斑块的减少完成治疗,如果获得批准,是否有科学和/或临床考虑因素可能会影响停止或继续给药的决定?
donanemab 治疗阿尔茨海默病的总体获益风险评估,是否有患者亚组的获益风险评估可能或多或少有利?
关于donanemab
大脑中β-淀粉样蛋白的沉积是AD的早期事件,它会导致由tau蛋白组成的神经纤维缠结和其他特征性脑部变化,被称为淀粉样蛋白级联。在过去的十年间,许多淀粉样蛋白靶向治疗试验未能显示出明显的临床疾病进展减缓效果,仅有aducanumab、lecanemab和donanemab最近显示出清除淀粉样蛋白斑块的效果。
Donanemab是一种免疫球蛋白G1单克隆抗体,针对仅存在于脑淀粉样蛋白斑块中的不溶性、修饰的N端截短形式的β淀粉样蛋白。
Donanemab能与N端截短形式的β淀粉样蛋白结合,并通过小胶质细胞介导的吞噬作用帮助清除斑块。
TRAILBLAZER-ALZ 2是一项评估了donanemab治疗AD的疗效和不良反应的3期试验。在这项3期试验中,与安慰剂相比,donanemab在低/中度tau和合并tau人群中iADRS主要结局以及在CDR-SB、ADASCog13和ADCS-iADL评分等次要临床结局中均显著减缓了阿尔茨海默病的进展。然而有1.6%的参与者出现了与淀粉样蛋白相关的影像学异常,导致严重后果,这也是FDA要求补充专家咨询委员会的关键原因。
AD治疗药物
回溯药企AD研发历程,堪称一部人类药物研发失败史。
2012年,强生/辉瑞的单抗药物Bapineuzumab的III期临床试验失败;
2014年,罗氏宣告Gantenerumab的III期临床试验失败;
2016年,礼来宣告III期临床药物Solanezumab没有达到主要临床终点;
2017年,默沙东宣布停止开发BACE抑制剂药物Verubecestat;
2018年,强生宣布其终止了BACE抑制剂剂Atabecestat II/III期临床试验;
众多制药企业投入了巨额资金,试图攻克这一领域,但最终都未能取得预期的成果,纷纷遭遇失败。
这一现状使得AD领域成为全球医药市场中潜在增长空间最大的领域之一。随着对AD治疗需求的不断增长,预计其将成为继心血管疾病、脑血管疾病和癌症之后,全球第医药市场,蕴藏着巨大的商业机会和发展前景。
截止2024年1月1日,有164项AD临床试验评估了127种潜在治疗药物,其中包括在3期测试了32种药物(共计48项试验);90项试验评估了81种处于2期的药物;以及26项一期试验,共计测试了25种潜在药物。

目前,FDA批准上市的治疗 AD 药物非常有限。
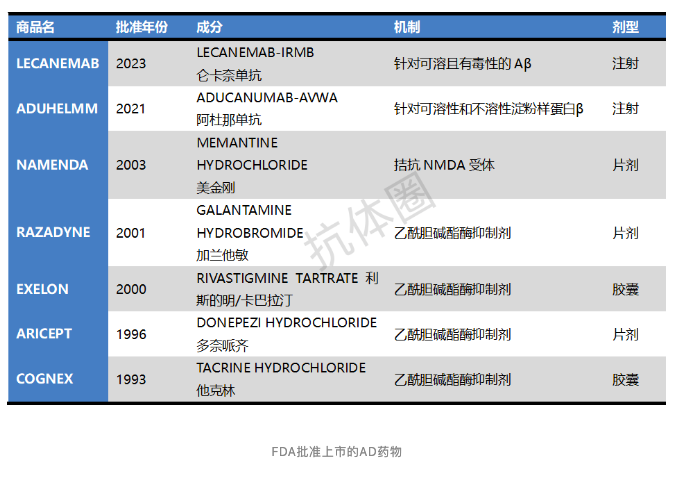
众多制药公司在AD的治疗研究中遭遇挫折,这无疑证明了AD是最具挑战性的医疗领域之一。随着治疗研发指南的更新和持续的资金投入,我们对未来可能面临的难题展现出了勇敢的战斗精神。即使在挑战中跌倒,我们也决心成为一道不可逾越的障碍,一座巍峨的山峰,一道坚固的防线。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!