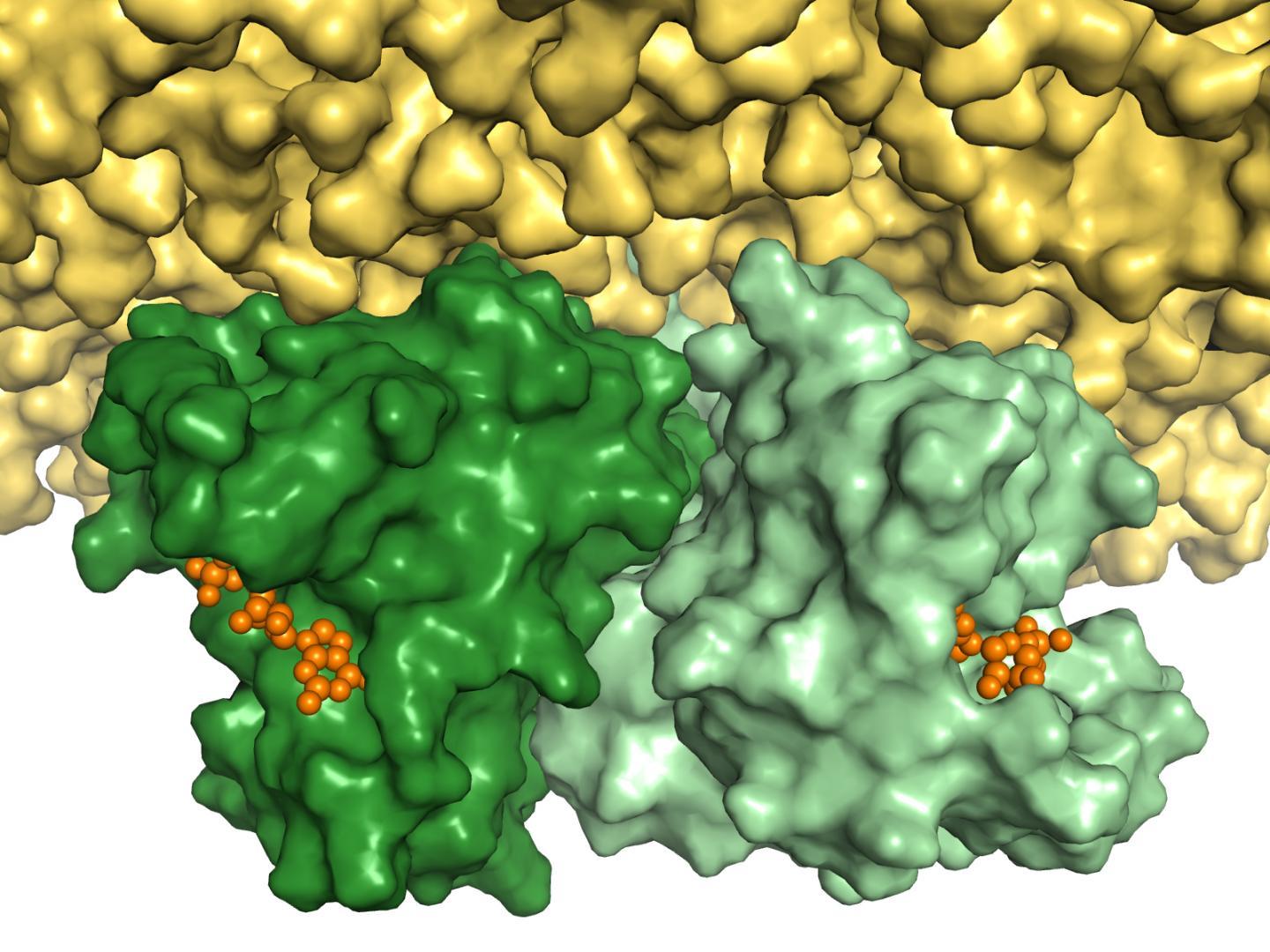
波鸿和奥斯纳布吕克的研究人员对 Ras 蛋白的结构有了新的见解,Ras 蛋白充当细胞生长的分子开关,并参与癌症的发展。在荧光标记的帮助下,他们已经证明蛋白质成对沉积在细胞膜上,并且具有他们在 2012 年理论上预测的结构。来自波鸿蛋白质诊断中心 (PRODI) 的团队希望这些发现将为开发癌症药物开辟一条新途径。来自波鸿鲁尔大学 (RUB) 和奥斯纳布吕克大学的研究人员于2021 年 5 月在《化学科学杂志》上发表了研究结果。
在激活状态下,Ras 蛋白与分子三磷酸鸟苷(简称 GTP)结合。Ras 将磷酸基团之一与 GTP 分子分离,从而关闭细胞生长。Ras 蛋白的故障可能会导致它保持活跃状态或延迟关闭。这会导致不受控制的细胞生长,从而导致癌症。迄今为止,几乎所有寻找与单个 Ras 蛋白对接的活性成分的尝试都失败了。
一对强
此后的其他研究表明,Ras 成对聚类会导致细胞生长的信号得到更好的传输。“如果我们能找到一种方法来使用一种活性成分来破坏一对出现故障的 Ras 蛋白的形成,那么它们对细胞生长的信号就会显着减弱,”PRODI 的创始董事 Klaus Gerwert 教授说。“因此,Ras 对结构的知识为活性成分对抗癌症提供了新的起点。”生物信息学方法可以帮助寻找潜在的活性成分。“然而,为此需要了解两种 Ras 蛋白之间界面的精确结构,”当前研究的主要作者 Till Rudack 博士解释说。
许多不同的矛盾对模型
2012 年,克劳斯·格沃特 (Klaus Gerwert) 领导的波鸿小组使用专门开发的计算机辅助和实验方法的组合,在细胞膜上确定了 Ras 对的结构。通过生物分子模拟,该小组还预测了两种蛋白质之间界面的初始模型。然而,界面的精确结构在接下来的几年里成为了有争议的话题,并且预测了许多其他相互矛盾的结构模型。“为了消除争议,需要实验数据来明确验证模型,”PRODI 项目组组长 Carsten Kötting 副教授说。这些数据由研究人员在他们目前的工作中提供。
他们使用 FRET 方法,即荧光共振能量转移的缩写,它充当一种分子尺度,用于测量蛋白质之间的距离。为此,用两种不同的染料标记两种蛋白质。如果它们靠得很近,能量就会从一种染料转移到另一种染料。蛋白质之间的距离是根据转移能量的比率确定的。为了确定这对中两个 Ras 蛋白的相对方向,研究人员必须测量不同点的距离。“我们采用了一种创新方法将氨基酸结合到 Ras 蛋白中,这些氨基酸在蛋白质中并不天然存在,但可以附着在染料上,”Carsten Kötting 解释说。
标签: Ras蛋白
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!