UBC 医学院的研究人员对 Omicron 变异刺突蛋白进行了世界上第一个分子水平的结构分析。研究结果今天发表在《科学》杂志上。
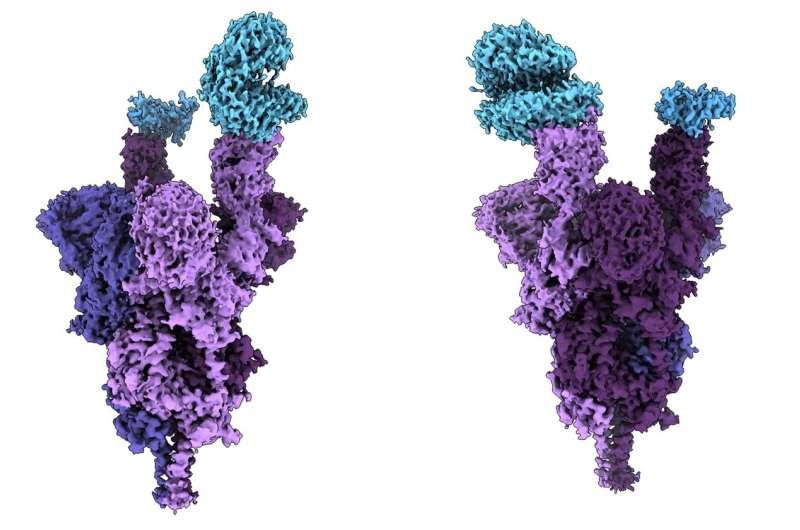
使用低温电子显微镜以近原子分辨率进行的分析揭示了严重突变的 Omicron 变体如何附着并感染人体细胞。
“了解病毒刺突蛋白的分子结构很重要,因为它将使我们能够在未来开发出针对 Omicron 和相关变体的更有效的治疗方法,”主要作者、UBC 系教授 Sriram Subramaniam 博士(他/他)说。生物化学和分子生物学。“通过分析病毒感染人体细胞的机制,我们可以开发出更好的治疗方法来破坏这一过程并中和病毒。”
位于外部的刺突蛋白使 SARS-CoV-2 能够进入人体细胞。Omicron 变体在其刺突蛋白上具有史无前例的 37 个突变,是以前的变体的三到五倍。
结构分析显示,几个突变(R493、S496 和 R498)在刺突蛋白和人类细胞受体 ACE2 之间产生了新的盐桥和氢键。研究人员得出结论,这些新键似乎增加了结合亲和力——病毒与人体细胞的结合强度——而其他突变(K417N)降低了这种键的强度。
“总体而言,研究结果表明,Omicron 比原始病毒具有更高的结合亲和力,其水平与我们看到的 Delta 变体更具可比性,”Subramaniam 博士说。“值得注意的是,尽管有如此广泛的突变,Omicron 变体仍能保持与人类细胞结合的能力。”
研究人员进行了进一步的实验,表明 Omicron 刺突蛋白表现出增加的抗体逃避。与之前的变体相比,Omicron 显示出对所有六种单克隆抗体的可测量逃避,完全逃避了五种。该变体还显示出对从接种疫苗的个体和未接种疫苗的 患者收集的抗体的逃避增加。
“值得注意的是,与未接种疫苗的患者对自然感染的免疫力相比,Omicron 对疫苗产生的免疫力的逃避程度较低。这表明疫苗接种仍然是我们最好的防御措施,”Subramaniam 博士说。基于观察到的结合亲和力和抗体逃避的增加,研究人员说,刺突蛋白突变可能是导致 Omicron 变体传播能力增加的因素。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!