心脏和骨骼肌作为可靠的生物机器的功能归功于它们最小的收缩结构,即肌节的组装,具有非凡的精度。产生将血液输送到所有器官并实现身体运动的能力——从呼吸到短跑——这些肌肉需要数百万种蛋白质成分的协调组装,这些蛋白质成分由人体最大的蛋白质——巨大的“统治者”——titin 、 nebulin 和 obscurin。
由于它们的体积很大,研究这些蛋白质充满了技术挑战。科学家们现在使用尖端的电子显微镜技术获得了 nebulin 的第一张高分辨率 3D 图像,nebulin 是一种巨大的肌动蛋白结合蛋白,是骨骼肌的重要组成部分。这一发现使我们有机会更好地了解 nebulin 的作用,因为它的功能由于其较大的尺寸和难以从肌肉中提取天然状态下的 nebulin 而一直保持模糊。
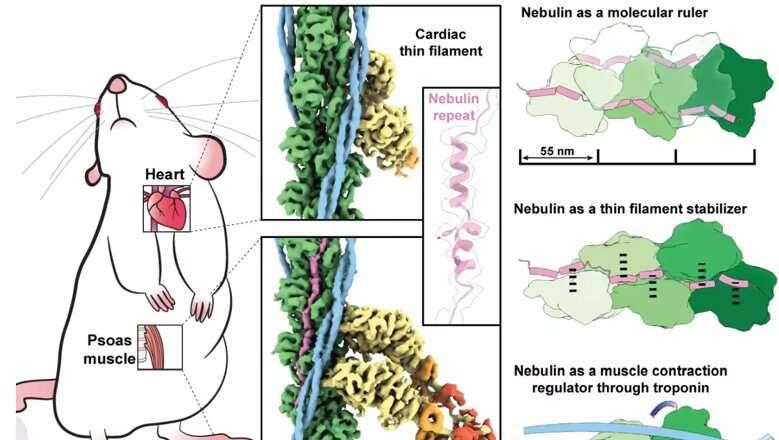
基础与医学生物科学学院院长 Mathias Gautel 教授、Ay Lin Kho 博士和由 Stefan Raunser 领导的 Max Planck 研究小组使用电子冷冻断层扫描技术以令人印象深刻的细节破译了 nebulin 的结构。他们的发现可能会导致治疗肌肉疾病的新治疗方法,因为nebulin 的基因突变伴随着肌肉力量的急剧下降,称为线虫肌病。
骨骼肌和心脏肌肉在肌球蛋白和肌动蛋白的平行细丝滑动时收缩和放松。Nebulin 是另一种细长的蛋白质,仅存在于骨骼肌中,与肌动蛋白配对,通过一系列称为重复的类似结构稳定和调节肌动蛋白。编码 nebulin 的基因突变会产生异常的 nebulin,从而导致线虫肌病,这是一种无法治愈的神经肌肉疾病,具有不同程度的严重程度,从肌肉无力到语言障碍和呼吸问题。
了解 nebulin 的结构以及它与肌动蛋白的相互作用可能对于开发新疗法至关重要。在这项研究中,研究人员能够通过使用一种称为电子冷冻断层扫描 (cryo-ET) 的强大显微镜技术直接在其原生环境肌肉中观察肌球蛋白和肌动蛋白。使用伦敦国王学院兰德尔细胞与分子生物物理中心实验室优化的程序,对与人类肌肉非常相似的小鼠肌肉进行了实验。引人注目的是,心肌肌动蛋白丝表明明显不存在 nebulin。
研究结果表明,每个 nebulin 重复与一个肌动蛋白亚基结合,证明了 nebulin 作为一个标尺的作用,它可以对肌动蛋白丝的长度进行分级。每个 nebulin 重复与每个相邻的肌动蛋白亚基相互作用,这解释了它作为稳定剂的作用。最后,科学家们提出,nebulin 可以通过与另一种称为肌钙蛋白的蛋白质相互作用来调节肌动蛋白和肌球蛋白的结合,从而调节肌肉收缩。
在他们最近的成功的推动下,该小组现在将专注于揭示肌球蛋白调节的结构细节,即肌肉的运动丝。这些发现最终可以帮助描绘骨骼和心肌收缩背后复杂细节的全貌。
该研究发表在《科学》杂志上。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!