由国立生理科学研究所领导并由北海道大学加入的一个研究小组探索了疼痛神经元在调节内毒素死亡中的作用。他们发现名为 Reg3γ 的肽作为一种富含疼痛神经元的脑靶向激素,可保护宿主免受内毒素死亡。
脓毒症是一种高死亡率疾病,当身体对病原体的免疫反应导致多器官缺陷时就会出现。尽管感染诱导的促炎细胞因子对于消除病原体是必不可少的,但这些因子的失调产生会导致内毒素休克。尽管在内毒素休克患者中广泛使用抗 TNF-α 抗体或糖皮质激素,但死亡率仍高达 30%。这些令人失望的结果表明,内毒素死亡的机制仅部分地由不受控制的炎症解释。
传统上对疼痛神经元的研究集中在离子通道上.天然疼痛传感器,如瞬时受体电位阳离子通道亚家族 V 成员 1 (TRPV1) 和 TRP 锚蛋白 1 (TRPA1) 在传入疼痛神经元中表达并触发疼痛以保护生物体免受进一步伤害。新出现的报告表明,受器官支配的疼痛神经元和 TRP 通道也调节真皮先天免疫、牛皮癣、胰岛功能、念珠菌病和骨髓炎。从机制上讲,这些现象被认为是由伤害感受器衍生肽的旁分泌引起的,例如降钙素基因相关肽 (CGRP) 和 VIP,它们调节免疫信号和内分泌途径。这些发现也提出了疼痛神经元衍生的“激素”是否存在的问题。
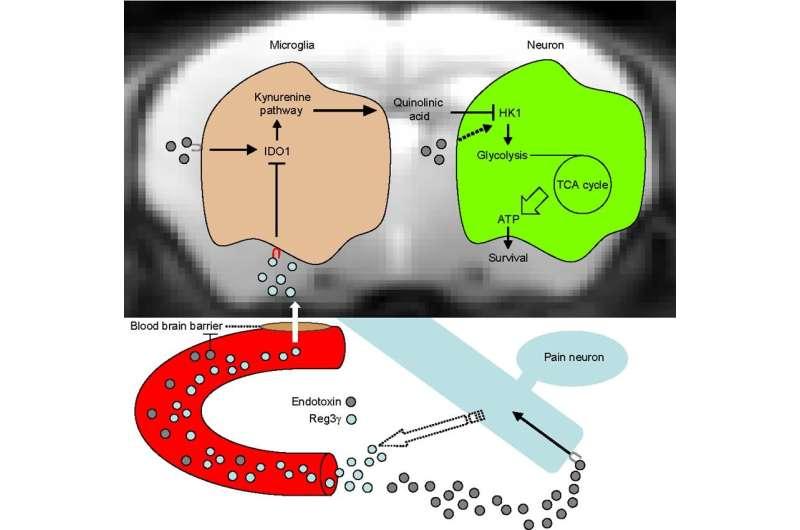
在这项新研究中,NIPS 的 Kenta Maruyama 博士、北海道大学的助理教授 Takeshi Kondo 及其同事揭示了疼痛神经元衍生肽 Reg3γ 穿透发炎的大脑并抑制小胶质细胞 IDO1 的表达,这是犬尿氨酸途径的关键酶。尽管炎症正常,但内毒素给药的疼痛神经元缺失小鼠和疼痛神经元特异性 Reg3γ 缺陷小鼠的死亡率很高,伴随着脑 HK1 磷酸化和 ATP 生成减少。这种代谢停滞仅在大脑中观察到,并且脑喹啉酸(犬尿氨酸途径的神经毒性代谢物)的异常产生导致 HK1 抑制。值得注意的是,Reg3γ 的脑给药通过增强脑功能保护小鼠免受内毒素死亡ATP 生产。通过将疼痛神经元衍生的 Reg3γ 鉴定为小胶质细胞靶向激素,这一发现为理解对内毒素死亡的耐受性提供了新的见解。
该研究发表在《细胞报告》上。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!