新泻——我们的大脑有执行独特功能的小动脉。衰老和高血压会损害这些动脉,导致步态障碍和痴呆症。这种疾病被称为脑小血管病 (CSVD)。众所周知,它与阿尔茨海默病高度相关。CSVD 在老年人中非常普遍,即使在广泛使用抗高血压药物的情况下也是如此。因此,在老龄化社会,迫切需要阐明与年龄相关的 CSVD 的分子发病机制并开发治疗方法。
CARASIL(伴有皮层下梗死和白质脑病的常染色体隐性脑动脉病)是一种遗传性 CSVD,由 HTRA1(高温需要 A 丝氨酸肽酶 1)功能障碍引起。它最初被报道为一种隐性遗传病,但近年来,在许多病例中报道了显性特征。HTRA1 作为与年龄相关的 CSVD 的风险基因也受到关注。最近的一份报告表明,英国每 450 人中就有 1 人携带风险突变。在 CARASIL 动脉病中,观察到内膜增厚,其变化类似于与年龄相关的 CSVD。因此,新泻大学的研究人员认为对CARASIL发病机制的研究也将导致对与年龄相关的CSVD发病机制的研究,并进行了他们的研究。
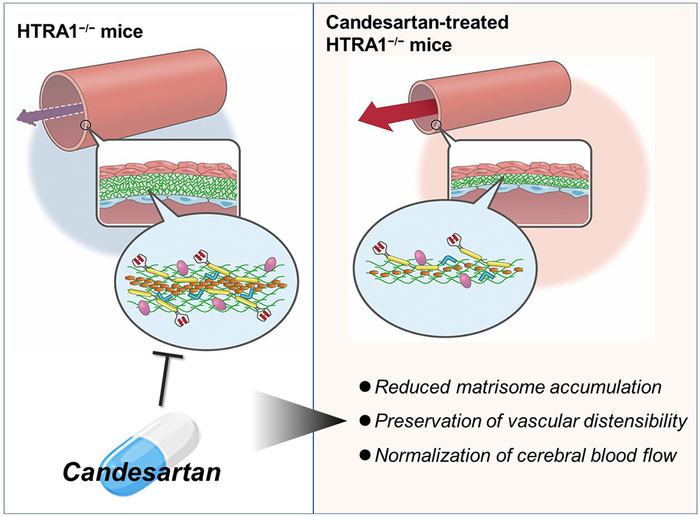
新泻大学和 RIKEN 的研究人员发现,一组称为基质体的蛋白质,由细胞外基质 (ECM) 和 ECM 结合蛋白组成,在衰老的 HTRA1 基因敲除小鼠的脑动脉中积累。结果,40% 的累积蛋白质由基质蛋白组成。还发现基质体蛋白在 CARASIL 患者的内膜中积累。基质体蛋白的积累随着年龄的增长而显着增加。此外,HTRA1 缺陷小鼠的脑血管变硬,脑血流量减少。积累的基质体蛋白包括纤连蛋白,它是基质体的核心成分和 HTRA1 的已知底物。
新泻大学脑研究所所长小野寺修教授说:“CARASIL的这种变化可能与HTRA1功能障碍导致基质体降解不充分以及衰老导致基质体增加有关。”
接下来,新泻大学和 RIKEN 研究人员检查了抗高血压药物坎地沙坦酯的作用,据报道,该药物可抑制纤连蛋白在其他器官中的积累。结果表明,无论其抗高血压作用如何,坎地沙坦治疗都减少了基质蛋白的积累并使血管僵硬和脑血流量正常化。
“我们所看到的是显着的。即使 HTRA1 完全不存在,61% 的累积基质蛋白也被抑制。这种影响并不伴随降解酶的增加或基质蛋白表达的抑制。我们认为澄清这一点很重要未来的机制,”研究团队的副教授 Taisuke Kato 博士说。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!