探讨库欣病中泛素特异性蛋白酶 8 活性的失调
东京理工大学的研究人员已经破解了泛素特异性蛋白酶 8 (USP8) 酶活性调节的分子机制。USP8 与库欣病的发病机制有关。他们在酶上发现了一个与其催化区域相互作用的自抑制区域。他们还提供了关于 USP8 突变导致的自身抑制释放是库欣病背后的根本原因的第一个证据。他们的发现对于了解库欣病的发病机制可能是无价的。
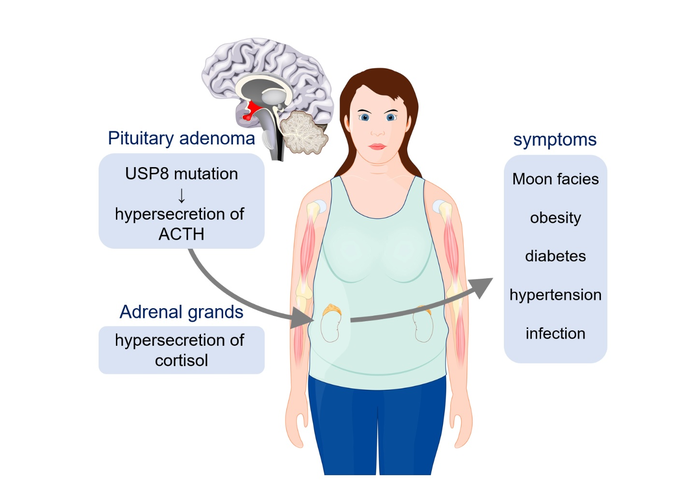
库欣病是由体内过量的类固醇激素皮质醇引起的(图 1),它影响着全世界成千上万的人,并且一直是广泛医学研究的主题。开发靶向疗法来治疗库欣病需要对其潜在的分子机制有透彻的了解。在分子水平上,泛素特异性蛋白酶 8 (USP8)(一种从蛋白质中裂解泛素的去泛素化酶)的突变与库欣病的发病机制有关。
通常,USP8 与一类称为 14-3-3 的衔接蛋白结合以进行抑制。库欣病中 USP8 的突变消除了 USP8 与 14-3-3 的这种结合,这会导致刺激皮质醇产生的促肾上腺皮质激素分泌过多——这是库欣病的标志。然而,关于这些突变对 USP8 功能影响的细节知之甚少。
因此,东京工业大学(Tokyo Tech)的一组研究人员深入研究了 USP8 的分子构成和工作原理,希望找到针对库欣病的治疗靶点。领导这项研究的东京工业大学创新研究所细胞生物学中心助理教授 Toshiaki Fukushima 博士解释了他们研究背后的动机,他说:“我们已经在探索突变的 USP8 在库欣病中的作用。了解突变对其活性调节的影响自然是我们研究的下一步。”
研究人员发现,野生型 USP8 在其 1118 个残基长的氨基酸序列中从 645 到 684 位拥有一个独特的氨基酸区域,该区域具有自身抑制特性(图 2)。发现该区域形成了类似WW的域结构。为了进一步探索,他们进行了生化分析,包括荧光共振能量转移测量和计算机对接模拟,并观察到 WW 样结构域与 USP8 的催化结构域结合以缩小形成泛素结合口袋的入口。 USP8 去泛素化反应中的重要位点。
接下来,研究人员发现通过 14-3-3 蛋白介导的 USP8 活性抑制部分是通过增强 WW 样结构域和催化结构域之间的相互作用来实现的。此外,他们分析了 USP8 致病突变的影响。研究人员在之前的实验中观察到,这些突变被发现消除了 USP8 与 14-3-3 的结合,抑制了 WW 样域和催化域之间的相互作用,并导致了 USP8 去泛素化活性的加剧(图 3)。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
6月25-28日,由中国进出境生物安全研究会、中国国际旅行卫生保健协会主办,中国青年创业就业基金会支持,中国出入...浏览全文>>
-
胃肠镜检查,听起来可能有些令人不安,但实际上,它可能是生活中的救命稻草。对于一些人来说,定期进行胃肠镜...浏览全文>>
-
6月16日-20日,2025年优秀博士后研究人员(绍兴)研学活动顺利举行。本次活动汇聚了来自全国各地的百余名博士后,...浏览全文>>
-
近日,天津松果生物医疗科技有限公司自主研发的牛跟腱来源去端肽I型胶原蛋白原材料成功通过国家药品监督管理局...浏览全文>>
-
在数字化产业转型的浪潮奔涌之际,病理学正经历着前所未有的革新机遇。奥伟登(Evident)凭借百年光学技术积淀,以...浏览全文>>
-
6月6-8日,CHINAGUT 2025中国肠道大会在宁波国际会议中心隆重举办。大会由南京医科大学第二附属医院、国家消化...浏览全文>>
-
在第28届北京国际口腔展这一行业风向标级盛会上,北京易岭生物科技有限公司(下面简称易岭生物)凭借重磅新品发...浏览全文>>
-
2025款上汽大众ID 4 X在安徽阜阳地区的售价会根据配置和选装包有所不同。基础版车型的厂商指导价大约在20万...浏览全文>>
-
岚图FREE,作为一款集豪华与智能于一体的新能源SUV,正以全新的姿态迎接每一位渴望高品质出行的用户。现在,岚...浏览全文>>
-
安徽阜阳的大众ARTEON 2022新款现已到店,最低售价从34 80万元起,无疑是近期购车的最佳时机。这款车型以其...浏览全文>>
