DNA(脱氧核糖核酸)包含生命发展和维持所需的遗传信息。该信息由信使核糖核酸 (mRNA) 传递以制造蛋白质。基于 mRNA 的疗法有潜力解决包括癌症和心血管疾病在内的多种疾病的未满足需求。可以将 mRNA 传递到细胞中以触发目标蛋白质的产生、降解或修饰,这是其他方法无法做到的。这种模式的一个关键挑战是能够将 mRNA 传递到细胞内,以便将其翻译成蛋白质。mRNA 可以装入脂质纳米颗粒 (LNP) 中——脂肪的小气泡——保护 mRNA 并将其运送到细胞中。然而,这个过程并不简单,
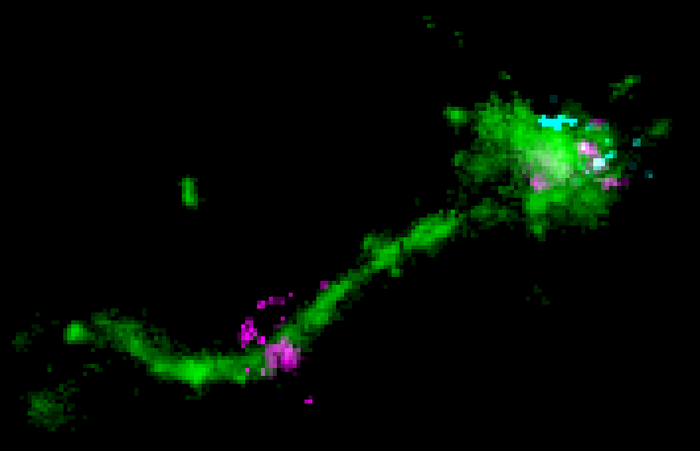
MPI-CBG 主任 Marino Zerial 团队的研究人员是使用高分辨率显微镜可视化细胞中分子(例如 mRNA)的细胞进入途径的专家。他们与阿斯利康 (AstraZeneca) 的科学家合作,后者为研究人员提供了脂质纳米颗粒原型,这些原型是他们开发的用于追踪细胞内 mRNA 的治疗方法。该研究发表在《细胞生物学杂志》上。
“要交付,mRNA 必须经过长途跋涉。封闭在脂肪 LNP 气泡中,它需要首先进入细胞,”Marino Zerial 解释说。“LNP 到达细胞表面,在那里它们与受体结合。然后它们被吸收到称为内体的特殊膜封闭隔室中。此时,mRNA 位于细胞内部,但被两个屏障包围,即脂肪泡和内体壁或更准确地说是膜。mRNA 面临的挑战是逃离这两个障碍以到达细胞质,在那里它作为制造蛋白质的模板。我们知道只有一小部分 RNA 分子能够逃逸到细胞质中。”内化的货物分子,如 LNP,首先被运输到“早期”内体。这些是物流中心,将货物分子分配到细胞中的各个目的地。它们要么将分子再循环到细胞表面,要么在晚期内体和溶酶体中降解它们。到目前为止,人们认为 mRNA 从晚期内体中逃逸,利用了它们的酸性含量。“通过单分子显微镜技术”,该研究的第一作者 Prasath Paramasivam 解释说,“我们可以第一次看到细胞内体内 LNP 中的 mRNA。我们还捕获了 mRNA 的实际逃逸,这种逃逸发生在循环内体的小管中,这些小管只是轻度酸性。”“我们的结果表明,将 LNP-mRNA 发送到晚期内体会适得其反,只会增加细胞毒性。 ” Zerial 说。这些发现有助于更详细地了解 mRNA 从内体中逃逸的机制。
Marino Zerial 总结道:“由于内体逃逸效率低,mRNA 的 LNP 递送系统需要高剂量。了解 mRNA 的去向以及它如何逃离内体使我们能够开发出更好的载体,以更低的剂量实现更有效的递送。我们可以改进 mRNA 递送系统,使其可用于治疗应用,例如癌症治疗。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!