马萨诸塞州剑桥——麻省理工学院的化学家发现了一种蛋白质的结构,可以将有毒分子从细菌细胞中泵出。在大肠杆菌中发现的与这种蛋白质相似的蛋白质被认为有助于细菌对多种抗生素产生抗药性。
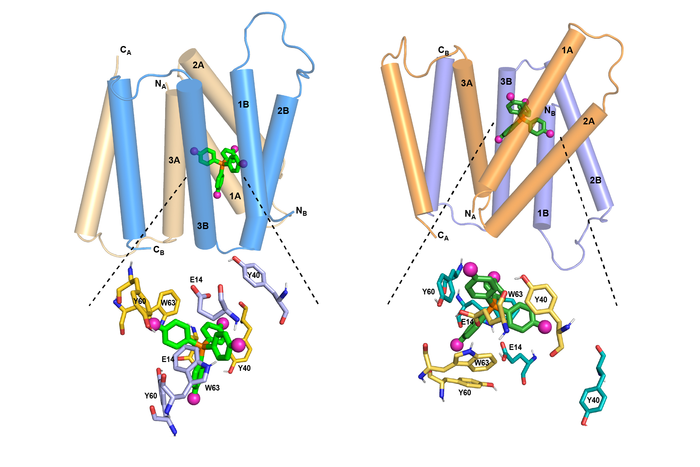
使用核磁共振 (NMR) 光谱,研究人员能够确定这种蛋白质的结构如何随着药物样分子的移动而发生变化。麻省理工学院化学教授梅红说,对这种详细结构的了解可能使设计能够阻断这些转运蛋白并帮助耐药细菌对现有抗生素重新敏感的药物成为可能。
“了解这种蛋白质的药物结合口袋的结构,人们可能会尝试设计这些底物的竞争者,这样你就可以阻断结合位点并阻止蛋白质从细胞中去除抗生素,”Hong 说,他是论文的高级作者。
麻省理工学院研究生 Alexander Shcherbakov 是该研究的主要作者,该研究今天发表在Nature Communications上。该研究团队还包括麻省理工学院研究生 Aurelio Dregni 和威斯康星大学麦迪逊分校的两名研究人员:研究生 Peyton Spreacker 和生物化学教授 Katherine Henzler-Wildman。
耐药转运蛋白
通过细胞膜将药物泵出是细菌可以用来逃避抗生素的众多策略之一。几年来,威斯康星大学的 Henzler-Wildman 小组一直在研究一种称为 EmrE 的膜结合蛋白,它可以运输许多不同的有毒分子,包括除草剂和抗菌化合物。
EmrE 属于称为小型多药耐药 (SMR) 转运蛋白的蛋白质家族。尽管 EmrE 不直接参与抗生素耐药性,但已发现该家族的其他成员存在于结核分枝杆菌和鲍曼不动杆菌的耐药形式中。
“SMR 转运蛋白在蛋白质的关键区域具有高度的序列保守性。EmrE 是迄今为止在体外和体内研究最多的家族成员,这使其成为研究支持 SMR 活性的结构的理想模型系统,”Henzler-Wildman 说。
几年前,Hong 的实验室开发了一种技术,允许研究人员使用 NMR 测量蛋白质中氟探针和氢原子之间的距离。这使得确定蛋白质与含氟分子结合时的结构成为可能。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!