伤口愈合和癌细胞侵袭等生物过程依赖于活细胞的集体和协调运动。影响这些过程的一个鲜为人知的方面是身体不同部位内部和之间的压力差。哥廷根大学和明斯特大学的研究人员使用胶原基质中的宫颈癌细胞设计了模型肿瘤系统,以研究压力差是否可以将癌细胞推入周围环境。将模型肿瘤嵌入软基质后,压力增加会导致突然爆发的快速和协调的细胞运动,从肿瘤向外喷射。他们的结果发表在Advanced Science上。
研究人员使用他们可以控制的简单 3D 组织中的宫颈癌细胞团设计了他们的模型系统,使他们能够系统地研究细胞在不同压力和环境中的行为。通常,单个细胞为了移动而对其环境施加力,而集体运动由细胞间的力协调,因为它们粘在一起并聚集在一起。然而,这种新模型使研究人员能够测量其他促进细胞运动的机制,例如体内不同区域之间的压力差。
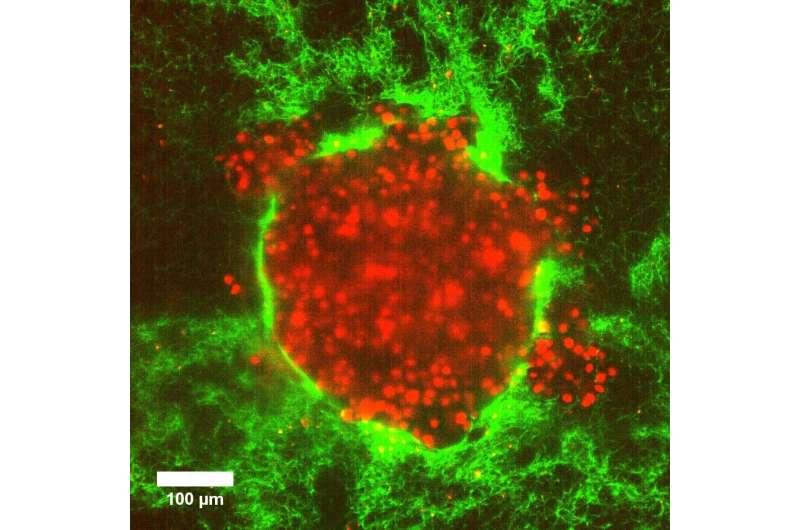
在柔软的 3D 胶原蛋白基质中使用癌细胞团块(它们的细胞核标记为红色)的肿瘤模型,显示压力如何导致癌细胞迅速爆裂成周围软基质中的囊袋。学分:Swetha Raghuraman 博士
使用允许科学家甚至在单个细胞水平上跟踪肿瘤变形的成像技术,研究人员发现,软基质中增加的压力通过触发细胞肿胀来驱动协调的细胞运动,而与细胞间的粘性无关。在将 3D 宫颈癌细胞团块嵌入软胶原蛋白基质中 8 小时后,它们突然爆发出大量癌细胞。当您将拇指按在顶部时,这种类似流体的推动机制表现出高细胞速度和突然的超级扩散运动,就像从软管中喷出的水一样。事实上,快速爆发似乎杀死了大约 80% 的细胞,但令人惊讶的是,剩余的细胞在接下来的四天里成功地嵌入到相同的环境中,并成倍增加。" 这意味着在最初的爆发后,剩余的活细胞仍然可以大量分裂和迁移。重要的是,当这种情况发生在人体内时,这可能被证明是极其危险的,通常会击败当前的癌症治疗方法,”哥廷根大学生物物理研究所的 Timo Betz 教授解释说。
嵌入更硬的胶原蛋白中的肿瘤模型并没有以同样的方式表现。事实上,即使在 7 天后,也完全没有爆发,这表明组织中的压力差是影响的重要部分。研究人员可以在较硬的胶原蛋白中触发“细胞爆裂”的唯一方法是在特定区域引入弱点。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!