中国科学院大连化学物理研究所(DICP)朴海龙教授领导的研究小组确定了去泛素酶泛素特异性蛋白酶22(USP22)与肝细胞癌脂质组异常积累的相关性。肝癌)。
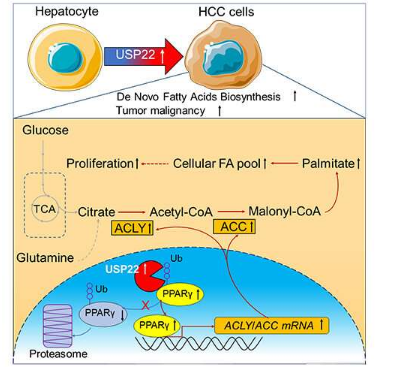
他们阐明了 USP22 调节的脂肪生成机制,该机制涉及过氧化物酶体增殖物激活受体 γ (PPARγ)-ATP 柠檬酸裂解酶 (ACLY) / 乙酰辅酶 A 羧化酶 (ACC) 轴在 HCC 肿瘤发生中的作用,并为通过治疗靶向脂肪生成提供了理论依据。 USP22 抑制。
该研究于4月21日发表在Nature Communications上。大连医科大学第一附属医院的徐国旺教授和大连医科大学第一附属医院的谭光教授也参与了这项研究。
代谢重编程是癌症的标志之一,其中异常增加的从头脂肪生成 (DNL) 是最常见的特征之一。
非分裂细胞中的脂肪酸合成速率较低,主要从细胞外循环中吸收脂质。相比之下,DNL,尤其是从头脂肪酸合成,是癌细胞的重要脂质来源。
在这项研究中,研究人员通过与配对的正常相邻组织相比,通过免疫印迹在 HCC 组织中检测了 USP 家族成员的表达。他们使用液相色谱-质谱法进一步筛选了不同的代谢物。
结果表明,USP22是最显着高表达的USP成员,USP22的高表达与脂质和类脂代谢物的上调相关。
分子和生化实验证实 USP22 通过 PPARγ 调节脂质代谢,PPARγ 是一种配体激活的转录因子,属于核激素受体家族,通过上调 ACC、ACLY 和脂肪酸合酶 (FASN) 等脂质合成酶来促进脂肪生成。
PPARγ 是 USP22 的底物,USP22 介导的去泛素化稳定了 PPARγ 并激活了 PPARγ 靶基因(即 ACC 和 ACLY),有助于脂肪生成和 HCC 肿瘤发生。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!