阿尔茨海默氏症和帕金森氏症等神经退行性疾病构成了重大的健康挑战,影响着全球超过 5000 万人。这些疾病的一个共同特征是大脑中错误折叠的蛋白质聚集体(称为淀粉样原纤维)的积累,它会破坏正常的细胞功能并最终导致细胞死亡。
在一项新的研究中,由洛桑联邦理工学院 (EPFL) 的 Hilal Lashuel 和南加州大学 (USC) 的 Matthew R. Pratt 领导的科学家在理解翻译后修饰 (PTM)(蛋白质在细胞中合成后发生的变化)如何影响方面取得了重大进展。这些淀粉样原纤维的形成和致病性。
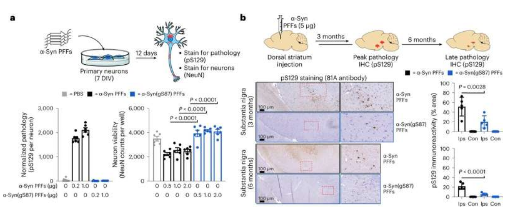
研究人员研究了α-突触核蛋白,它与帕金森病中淀粉样原纤维的形成有关。研究人员研究了该蛋白质经历的特定修饰,技术上称为“O-连接β-N-乙酰葡糖胺”或简称O-GlcNAc。
O-GlcNAc 是一种修饰,将单个糖分子添加到蛋白质中的特定丝氨酸或苏氨酸残基上,从而改变其功能和性质。它与多种生物过程有关,包括蛋白质聚集和神经变性。这种修饰,特别是对 α-突触核蛋白的修饰,已被证明可以减缓淀粉样蛋白的聚集并可能保护神经元。
Pratt 和 Lashuel 团队之前的研究表明,增加 O-GlcNAc 修饰可能在神经退行性疾病的早期阶段具有治疗潜力,改变蛋白质聚集体的特性以防止其在大脑中播种和扩散,从而可能减缓疾病进展。
在此基础上,该团队与宾夕法尼亚大学的 Virginia Lee 团队合作,采用创新的化学方法来生产修饰的 α-突触核蛋白原纤维。他们还使用细胞和动物模型来研究 O-GlcNAc 如何影响 α-突触核蛋白的致病特性,并与 UT 西南医学中心的 Lorena Saelices 团队合作,用冷冻电子显微镜观察修饰的原纤维。
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!