由西北大学和威斯康星大学麦迪逊分校领导的研究人员推出了一种开创性的方法,旨在对抗阿尔茨海默病、帕金森病和肌萎缩侧索硬化症(ALS)等神经退行性疾病。
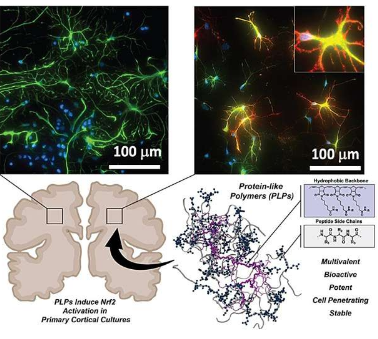
在一项新研究中,研究人员发现了一种增强人体抗氧化反应的新方法,这对于细胞保护细胞免受与许多神经退行性疾病有关的氧化应激至关重要。
该研究今天发表在《先进材料》杂志上。
西北大学温伯格艺术与科学学院Jacob&RosalineCohn化学教授、国际纳米技术研究所成员NathanGianneschi与威斯康星大学麦迪逊分校的JeffreyA.Johnson和DelindaA.Johnson共同领导了这项工作。药店。
针对神经退行性疾病
阿尔茨海默氏病,其特征是β-淀粉样斑块和tau蛋白缠结的积累;帕金森病,以其多巴胺能神经元的丧失和路易体的存在而闻名;肌萎缩侧索硬化症(ALS)涉及运动神经元的退化,它们都有一个共同的线索:氧化应激导致疾病病理。
该研究的重点是破坏Keap1/Nrf2蛋白质-蛋白质相互作用(PPI),该相互作用在人体的抗氧化反应中发挥作用。通过选择性抑制Nrf2与Keap1的相互作用来防止Nrf2降解,该研究有望减轻这些衰弱状况下的细胞损伤。
JeffreyJohnson说:“在过去的二十年里,我们将Nrf2作为治疗神经退行性疾病的主要靶点,但这种激活该通路的新方法为开发疾病缓解疗法带来了巨大的希望。”
当前疗法的局限性
研究小组着手解决神经退行性疾病治疗中最具挑战性的方面之一:细胞内PPI的精确靶向。传统方法,包括小分子抑制剂和基于肽的疗法,由于缺乏特异性、稳定性和细胞摄取而存在不足。
该研究引入了一种创新的解决方案:类蛋白聚合物(PLP)是通过降冰片烯基肽单体的开环复分解聚合(ROMP)合成的度刷状大分子结构。这些球状蛋白质模拟结构显示出生物活性肽侧链,可以穿透细胞膜,表现出显着的稳定性并抵抗蛋白水解。
这种抑制Keap1/Nrf2PPI的靶向方法代表了一次重大飞跃。通过阻止Keap1标记Nrf2降解,Nrf2在细胞核中积累,激活抗氧化反应元件(ARE)并驱动解毒和抗氧化基因的表达。这种机制有效增强细胞抗氧化反应,为许多神经退行性疾病中涉及的氧化应激提供有效的治疗策略。
类蛋白质聚合物背后的创新
由Gianneschi团队开发的PLP可能代表着在阻止或逆转损伤方面的重大突破,为改善治疗和结果带来希望。
该团队的研究重点关注激活对人体抗氧化反应至关重要的过程的挑战,提供了一种新颖的解决方案。该团队提供了一种强大的选择性方法,能够增强细胞保护,并为包括神经退行性疾病在内的一系列疾病提供有前景的治疗策略。
“通过现代聚合物化学,我们可以开始考虑模仿复杂的蛋白质,”詹内斯基说。“希望在于开发一种新的治疗设计方式。这可能是解决阿尔茨海默氏症和帕金森氏症等传统方法难以解决的疾病的一种方法。”
这种方法不仅代表了针对转录因子和无序蛋白质的重大进展,而且还展示了PLP技术的多功能性和彻底改变治疗方法开发的潜力。该技术在抑制Keap1/Nrf2相互作用方面的模块化和功效强调了其作为治疗方法的潜力,同时也作为研究这些过程的生物化学的工具。
心灵的协作
Gianneschi的团队强调了该研究的协作性质,并与跨学科的专家密切合作,展示了将材料科学与细胞生物学相结合以应对复杂的医学挑战的巨大潜力。
JeffreyJohnson表示:“由于我们之前在阿尔茨海默病、帕金森病、ALS和亨廷顿病模型中对Nrf2进行了研究,Gianneschi教授及其同事联系了我们,提议将这种新颖的PLP技术用于治疗神经退行性疾病。”“我们从未听说过这种Nrf2激活方法,并立即同意启动这项合作努力,最终产生了大量数据并出版了这份出版物。”
这种伙伴关系强调了跨学科研究在开发新治疗方式方面的重要性。
影响
随着这项创新技术的发展,Gianneschi和他在国际纳米技术研究所和威斯康星大学麦迪逊分校约翰逊实验室的同事们不仅在推进药物化学领域的发展,而且还开辟了新的途径来对抗一些当今社会面临的最具挑战性和破坏性的神经退行性疾病。随着这项研究向临床应用迈进,它可能很快就会为患有阿尔茨海默病和帕金森病等氧化应激疾病的人们带来新的希望。
“通过控制单纳米尺度的材料,我们为对抗比以往任何时候都更加普遍但仍然无法治愈的疾病开辟了新的可能性,”Gianneschi说。“这项研究只是一个开始。随着我们继续探索和扩大大分子药物的开发,我们对这种可能性感到兴奋,这些药物能够使用我们的PLP平台模拟蛋白质的某些方面。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!