淀粉样β蛋白(A-β)聚集体是蛋白质的缠结物,与阿尔茨海默氏症等神经退行性疾病密切相关。尽管淀粉样β蛋白聚集体一直备受关注,但研究人员一直无法很好地理解淀粉样β蛋白如何聚集和分解。
“A-beta 在各种环境中的行为方式,包括人类大脑,都难以捉摸,”圣路易斯华盛顿大学电气系统与工程专业校友、现为医学院医学博士生的 Brian Sun 说道。“人们对生长和衰退的理解还不够透彻。”
这一现状即将改变,这要归功于孙建军与华盛顿大学麦凯维工程学院普雷斯顿 M. 格林电气与系统工程系 Matthew Lew 实验室的同事最近在《纳米快报》上发表的一项研究。
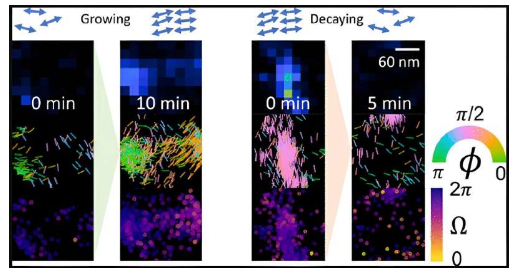
在这项开创性的工作中,孙和同事能够测量淀粉样蛋白原纤维β-片层组件(蛋白质聚集体的底层支柱)的变化情况。之前的高分辨率显微镜研究只获得了静态照片。
论文第一作者孙文斌表示:“我们希望特别研究 A-beta 底层结构的动态,这可能是导致我们所看到的变化的原因,而不仅仅是整体形状的变化。”
刘易斯用乐高积木打了个比方,指出当前的成像技术可以展示完整的乐高积木,但无法展示单个积木是如何排列的。
“单个蛋白质总是根据环境变化,”刘副教授说。“这就像某些乐高积木会导致其他积木改变形状。蛋白质结构的变化和组装的聚集体共同导致了神经退行性疾病的复杂性。”
标签:
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!